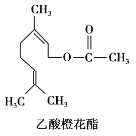
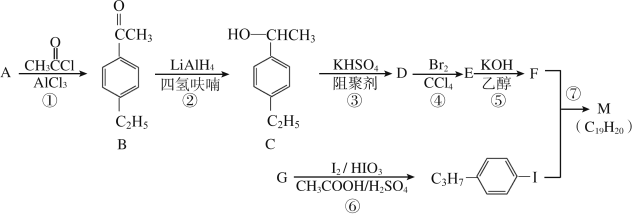
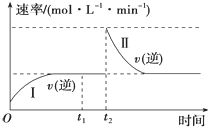
题目内容
【题目】一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是

A.该电池放电时的正极反应为2Li-2e-+CO32-===Li2CO2
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-===3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
【答案】D
【解析】
放电时,负极:Li-e-=Li+,正极:3CO2+4e-+4Li+=2Li2CO3+C,总反应为:4Li+ 3CO2=2Li2CO3+C。充电时只有Li2CO3发生氧化:阳极:2Li2CO3-4e-=4Li+ +2CO2↑+O2↑,阴极:4Li+ +4e-=4Li,总反应为:2Li2CO3=4Li+2CO2↑+O2↑,依据此分析解答。
A.正极发生还原反应,得电子,故A错误;
B.Li能与水反应,所以不能选用含水电解液,故B错误;
C.充电时只有Li2CO3发生氧化,阳极:2Li2CO3-4e-=4Li+ +2CO2↑+O2↑,故C错误;
D.电池每放、充转移4 mol电子就有1 mol碳氧化生成二氧化碳,所以该电池每放、充4 mol电子一次,理论上能固定1 mol二氧化碳,故D正确;
答案选D。

【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
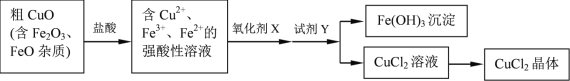
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________