题目内容
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入_____________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_______________。
(4)某酸H2B在水溶液中有如下变化:H2B![]() H++HB-;HB-
H++HB-;HB-![]() H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:_________________________
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是__________0.11 mol·L-1(填“<”,“>”,或“=”),理由是__________
【答案】c(NH4+ )>c(SO42- )>c(H+)>c(OH-) HCO3的水解程度大于其电离程度,溶液中 c(OH-)>c( H+),故溶液显碱性 盐酸 Fe3++3HCO3- =Fe(OH)3↓+3CO2↑ 0.01<n(H+)<0.02 < 由于H2B第一步完全电离(H2B![]() H++HB-),所以c(H+)为0.1mol/L,HB-继续电离,但是受到第一步生成H+的影响,电离受到抑制因此c(H+)小于0.11mol/L
H++HB-),所以c(H+)为0.1mol/L,HB-继续电离,但是受到第一步生成H+的影响,电离受到抑制因此c(H+)小于0.11mol/L
【解析】
(1)根据溶液中NH4+水解,溶液呈酸性,水解程度微弱,分析比较;
(2)HCO3-的水解程度大于电离程度;
(3)Fe3+水解的方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,加酸可使水解平衡逆向移动,即抑制Fe3+水解;将NaHCO3和FeCl3混合后,发生双水解;
Fe(OH)3+3H+,加酸可使水解平衡逆向移动,即抑制Fe3+水解;将NaHCO3和FeCl3混合后,发生双水解;
(4)①根据电离的程度来确定H+物质的量的大小;
②0.1mol·L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,说明电离度为10%,H2B第一步完全电离,第二步部分电离,且含有相同的离子,能抑制弱根离子的电离;
(1)NH4+水解,溶液呈酸性,有c (H+)>c (OH-),0.1 mol/L的(NH4)2SO4溶液中,NH4+水解微弱,因此离子浓度的大小关系为:c(NH4+ )>c(SO42- )>c(H+)>c(OH-);
(2)在NaHCO3溶液中存在水解平衡:HCO3-+H2O![]() H2CO3+OH-,电离平衡:HCO3-
H2CO3+OH-,电离平衡:HCO3-![]() H++CO32-,但以水解为主,即HCO3-的水解程度大于电离程度,因此溶液显碱性;
H++CO32-,但以水解为主,即HCO3-的水解程度大于电离程度,因此溶液显碱性;
(3)Fe3+水解的方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,加盐酸可即抑制Fe3+水解;将NaHCO3和FeCl3混合后,发生双水解,反应为:Fe3++3HCO3- =Fe(OH)3↓+3CO2↑;
Fe(OH)3+3H+,加盐酸可即抑制Fe3+水解;将NaHCO3和FeCl3混合后,发生双水解,反应为:Fe3++3HCO3- =Fe(OH)3↓+3CO2↑;
(4)①根据H2B![]() H++HB-,HB-
H++HB-,HB-![]() H++B2-可知,第一步电离是完全电离,第二步是部分电离,因此0.01<n(H+)<0.02;
H++B2-可知,第一步电离是完全电离,第二步是部分电离,因此0.01<n(H+)<0.02;
②0.1mol·L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,说明电离度为10%,H2B第一步完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,因此0.1mol·L-1 H2B溶液中氢离子的物质的量浓度<0.11 mol·L-1。

【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
【题目】![]() ,向5L恒容密闭容器中充入
,向5L恒容密闭容器中充入![]() 气体,发生反应
气体,发生反应![]() ,一段时间后达到平衡,测得此过程中从外界共吸收了
,一段时间后达到平衡,测得此过程中从外界共吸收了![]() 的热量.当温度度不变时,改变某一条件,下列结论正确的是
的热量.当温度度不变时,改变某一条件,下列结论正确的是![]()
条件改变 | 结论 | |
A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
B | 起始时向容器中充入 | 反应达到平衡前 |
C | 起始时向容器中充入 | 达到平衡时共放出 |
D | 起始时向容器中充入 | 达到平衡时, |
A.AB.BC.CD.D
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
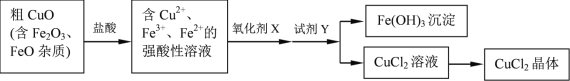
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。




