题目内容
6.含银化合物有着某些特殊的性质和重要的用途.Ⅰ.为探究AgNO3 的分解产物,某化学兴趣小组设计了如下实验,加热装置A,产生红棕色气体,在装置D中收集到O2,当反应结束以后,试管中残留的固体为黑色.

(1)装置B的作用是防倒吸;
(2)【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:a.Ag;b.Ag2O;c.Ag和Ag2O.
【实验验证】①该小组为验证上述设想,分别取少量黑色固体,加入足量稀硝酸,振荡,发现黑色固体完全溶解.并有气体产生,由此可知该黑色固体中一定含有Ag(填化学式),可能存在Ag2O(填化学式),写出上述过程中产生的气体的化学方程式3Ag+4HNO3═3Ag(NO3)3+NO↑+2H2O.
②为进一步确定该黑色固体的成分,尚需选用的试剂是氨水;
Ⅱ.准确称取某含银样品(设仅含Ag2O2和Ag2O)7.120g.在一定条件下完全分解为Ag和O2,得到448.0mL(标准状况),则样品中Ag2O2的质量分数是34.83%.(写出解题过程,计算结果精确到小数点的后两位)
分析 I.(1)装置中B为安全瓶防倒吸;
(2)①硝酸与Ag反应生成NO气体,硝酸与氧化银反应无明显现象;
②Ag2O可溶于氨水,Ag不溶于氨水,可以用氨水检验是否有氧化银;
II.Ag2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+O2↑,2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑,根据反应方程式和已知数据结合质量守恒列方程组计算.
解答 解:(1)装置导气管略露出胶塞,是安全瓶,可以防止C装置中 的液体到吸入发生装置A,
故答案为:防倒吸;
(2)①硝酸与Ag反应生成NO气体,有气体生成说明固体中含有Ag,由于硝酸与氧化银反应无明显现象,所以不能判断是否含有氧化银,则固体中可能含有Ag2O;Ag与稀硝酸反应生成NO、硝酸银和水,其反应方程式为:3Ag+4HNO3═3Ag(NO3)3+NO↑+2H2O;
故答案为:Ag;Ag2O;3Ag+4HNO3═3Ag(NO3)3+NO↑+2H2O;
②Ag2O可溶于氨水,Ag不溶于氨水,可以用氨水检验是否有氧化银,所以要检验固体中是否含有氧化银,可以把固体加如盛有氨水的烧杯中,若固体溶解或部分溶解,说明含有氧化银;
故答案为:氨水;
II.已知分解反应为:Ag2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+O2↑,2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑,
n(O2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
设样品中Ag2O2的物质的量为x,Ag2O 的物质的量为y
248g/mol×x+232g/mol×y=7.120g
x+$\frac{y}{2}$=0.02mol
解得:x=0.01,y=0.02,
则样品中Ag2O2的质量分数是$\frac{0.01mol×248g/mol}{7.120g}$×100%=34.83%;
故答案为:34.83%.
点评 本题考查了实验设计的方法和物质实验验证方案分析判断,物质性质的应用是解题关键,题目难度中等,侧重于考查学生的对基础知识的应用能力和计算能力.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | Mg | B. | Cu | C. | Ag | D. | H2 |
| A. | 能说明盐酸是强酸:2HCl+CaCO3═CaCl2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.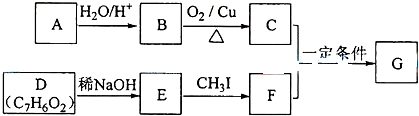
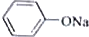 +RCH2I→
+RCH2I→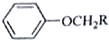
 .
.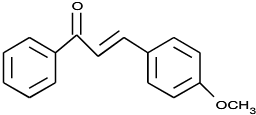 .
.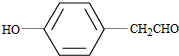 (写结构简式).
(写结构简式).

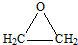 .
.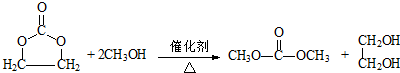 .
.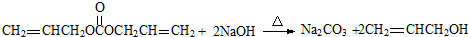 .
. .
.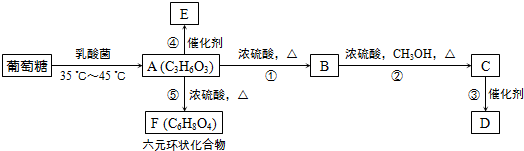
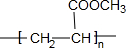 ,⑤2
,⑤2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.