题目内容
1.下列所述事实与化学(离子)方程式不相符的是( )| A. | 能说明盐酸是强酸:2HCl+CaCO3═CaCl2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
分析 A.碳酸为弱酸,只能证明盐酸的酸性大于碳酸,不能证明盐酸为强酸;
B.氧化还原反应中,氧化性大小为:氧化剂>氧化产物;
C.氨气能够与水和氢离子反应生成铵根离子和水,证明了氨气结合氢离子能力较强;
D.醋酸根离子在溶液中能够发生水解,证明了醋酸为弱酸.
解答 解:A.反应2HCl+CaCO3═CaCl2+CO2↑+H2O中,盐酸置换出碳酸,证明了盐酸的酸性大于碳酸,由于碳酸是弱酸,无法证明盐酸是强酸,故A错误;
B.氧化还原反应2Fe2++H2O2+2H+═2Fe3++2H2O中,双氧水为氧化剂,铁离子为氧化产物,则氧化性H2O2>Fe3+,故B正确;
C.NH3+H3O+═NH4++H2O反应中,氨气与水和氢离子反应生成了铵根离子,证明了NH3结合H+能力比H2O强,故C正确;
D.根据反应CH3COO-+H2O?CH3COOH+OH-可知,醋酸根离子在溶液中能够发生水解,证明了醋酸为弱酸,故D正确;
故选A.
点评 本题考查了离子方程式、化学方程式的应用,题目难度中等,注意掌握离子方程式、化学方程式的书写原则,明确氧化还原反应中氧化性、还原性强弱的判断方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
11.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
12.某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
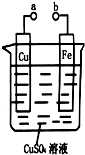

| A. | a和b不连接时,铁片上会有金属铜析出,从而使铁的腐蚀速率加快 | |
| B. | a和b用导线连接时,铜片上发生的反应为Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极,能实现铁上镀铜,并使Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解 |
16.X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子层数,(选项中m、n均为正整数)下列有关叙述正确的是( )
| A. | 若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 | |
| B. | 若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 | |
| C. | 若X、Y原子序数相差1,Y为ⅡA族,则X一定是ⅢA族 | |
| D. | 若Y(OH)m易溶于水,则X(OH)n一定不溶于水 |
13.对下列四种有机物的分析,正确的是( )
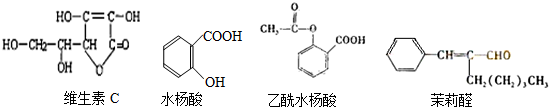

| A. | 水杨酸和茉莉醛均能发生银镜反应 | |
| B. | 乙酰水杨酸可以由水杨酸发生酯化反应生成 | |
| C. | 四种有机物都含有碳碳双键,都能和氢气发生加成反应 | |
| D. | 四种机物中只有乙酰水杨酸能发生水解反应 |
10.短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的3倍,回答下列问题:
(1)甲在元素周期表中的位置第三周期ⅣA族;
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
| 乙 | 丙 | 丁 | |
| 甲 | 戊 |
(2)原子半径:甲>丁(填“<”、“>”或“=”);
(3)元素的非金属性:甲<丙(填“<”、“>”或“=”).
5.巴豆酸的结构简式为CH3CH=CH-COOH,现有①氯化氢、②溴水、③纯碱溶液、④酸性高锰酸钾溶液、⑤2-丁醇. 试根据其结构特点判断在一定条件下能与巴豆酸反应的物质的组合是( )
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |