题目内容
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
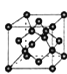
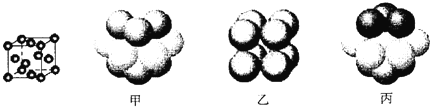
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
【答案】CO NH3分子间能形成氢键,而HCl分子间没有氢键 N>C>Na 3d84s2 sp sp3 丙
【解析】
T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素
(1)与N2互为等电子体的物质为CO;
(2)NH3分子间能形成氢键,而HCl分子间没有氢键,故NH3的沸点故HCl的沸点;
(3)非金属性越强,电负性越大,故电负性N>C>Na;
(4)元素Q的原子序数是Na与Cl的原子序数之和,则Q的原子序数为11+17=28,则Q为Ni元素;①Ni元素原子的核外电子排布式为1s22s22p63s23p63d84s2,其最外层电子排布为3d84s2;②平面型的[Ni(CO)4]2-和四面体的[NiCl4]2-,CO分子中C原子价层电子数为1+(4-2)/2=2,C原子采取sp杂化,[NiCl4]2-是四面体结构,Ni原子采取sp3杂化;③由图可知,Ni的晶体为面心立方堆积,即为“ABC”结构,原子堆积方式是为丙。
【点晴】
能结合元素的结构特点快速判断元素是解答关键。T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素,据此解答。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案