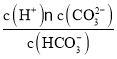题目内容
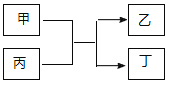
【题目】向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断正确的是![]()
A.整个过程共发生2个氧化还原反应
B.在该溶液中滴少量品红,品红褪色
C.所有离子的浓度都发生了变化
D.反应过程中氯气既作氧化剂又作还原剂
【答案】B
【解析】
A.氯气发生了氧化SO32-、Br-的反应,还存在氯气和水的反应,共有3个氧化还原反应,A错误;
B.氯气过量,溶液中含HClO,具有漂白性,向溶液中滴少量品红,品红褪色,B正确;
C.SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,所有阴离子的浓度都发生了变化,但Na+浓度不变,C错误;
D.氯气与SO32-、Br-反应中得到电子,氯气作氧化剂,而只有氯气与水反应中Cl元素的化合价既升高又降低,氯气既作氧化剂又作还原剂,D错误;
故选B。

【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
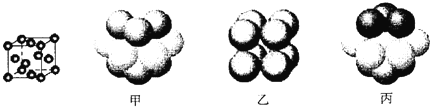
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
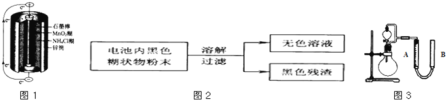
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。