题目内容
【题目】X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。

【答案】 3Mg(NH2)2=Mg3N2+4NH3↑ ①②③ 1s22s22p63s23p63d8 26 sp2杂化 7 平面三角 CO32- BF3 HNO3 0.97
【解析】本题考查杂化类型、电子排布式、等电子体等,Z基态原子最外层电子数是其内层电子总数的3倍,Z是O,因为原子序数依次增大,则Y位于第二周期,p能级上有3个原子轨道,Y基态原子是同周期元素中未成对电子数最多的原子,即Y为N,X分别与Y、Z元素组合成10电子微粒,即NH3、H2O,推出X为H,W的基态原子有10个价电子,说明W属于第四周期过渡元素,价电子排布式为3d84s2,W为Ni,(1)根据信息,NH2-与OH-类似,Mg(NH2)2的性质与Mg(OH)2的相似,因此Mg(NH2)2分解的化学反应方程式为:3Mg(NH2)2=Mg3N2+4NH3↑;(2)水中存在氢键,氢键有方向性和饱和性,金刚石中存在共价键,共价键有方向性和饱和性,H2O中中性原子为O,O的杂化类型为sp3,金刚石中C的杂化类型为sp3,水属于分子晶体,金刚石属于原子晶体,晶体类型不同,故选项①②③正确;(3)①Ni原子核外电子排布式为1s22s22p63s23p63d84s2,其Ni2+核外电子排布式为:1s22s22p63s23p63d8;每个电子的运动状态不同,因此有多少个电子,就有多少种运动状态不同的电子,即有26种运动状态不同的电子;②尿素的结构简式为: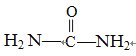 ,碳原子有3个σ键,无孤电子对,因此杂化类型为sp2;成键原子之间只能形成一个σ键,因此1mol尿素中含有σ键数目是7NA;③此离子是NO3-,其中N的杂化类型为sp2,NO3-空间构型为平面三角形;等电子体的空间构型相似,即阴离子为CO32-,中性分子是BF3,HNO3写成HO(NO2),HNO2写成HO(NO),非羟基氧越多,酸性越强,即HNO3酸性强;④NiO中Ni的化合价为+2价,样品中W3+与W2+的离子数之比为6:91,根据电中性,得6×x×3/97+91×x×2/97=2,解得x=0.97。
,碳原子有3个σ键,无孤电子对,因此杂化类型为sp2;成键原子之间只能形成一个σ键,因此1mol尿素中含有σ键数目是7NA;③此离子是NO3-,其中N的杂化类型为sp2,NO3-空间构型为平面三角形;等电子体的空间构型相似,即阴离子为CO32-,中性分子是BF3,HNO3写成HO(NO2),HNO2写成HO(NO),非羟基氧越多,酸性越强,即HNO3酸性强;④NiO中Ni的化合价为+2价,样品中W3+与W2+的离子数之比为6:91,根据电中性,得6×x×3/97+91×x×2/97=2,解得x=0.97。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】根据下列实验或实验操作和现象,所得结论正确的是:
选项 | 实验或实验操作 | 现象 | 实验结论 |
A | 用大理石和盐酸反应产生的气体立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
【题目】有X、Y、Z、T四种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)常见的两种化合物。
X | |
Y | Z |
(1)各元素的符号是X______,Y________,Z________、T___________。
(2)Y原子的结构示意图为______________________________________________。
(3)用电子式表示Y与T组成的化合物的形成过程:_____________________。
(4)X和Y的氢化物的稳定性_________(用化学式表示)。
【题目】Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。




