题目内容
【题目】完成下列化学方程式
(1)乙二醛与银氨溶液:___;
(2)苯酚钠溶液中通入少量CO2:___;
(3)足量乙酸与乙二醇发生酯化反应:___;
(4)乙醛与甲醇的加成反应:___。
【答案】OHC-CHO+4[Ag(NH3)2]OH→H4NOOC-COONH4+4Ag↓+6NH3+2H2O C6H5ONa +CO2+H2O→C6H5OH+NaCO3 2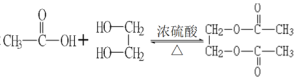 +2H2O CH3CHO+CH3OH→CH3CH(OH)OCH3
+2H2O CH3CHO+CH3OH→CH3CH(OH)OCH3
【解析】
(1)醛类物质能与银氨溶液发生氧化反应;
(2)苯酚钠溶液中通入少量的CO2,根据强酸制弱酸原理书写方程式;
(3)羧酸与醇发生酯化反应,生成酯和水;
(4)乙醛结构中含有醛基,可发生加成反应;
(1)乙二醛能与银氨溶液发生氧化反应,生成乙二酸铵,银单质,氨和水,反应方程式为:OHC-CHO+4[Ag(NH3)2]OH→H4NOOC-COONH4+4Ag↓+6NH3+2H2O;
(2)苯酚钠溶液中通入少量的CO2,根据强酸制弱酸原理可知反应后生成苯酚和碳酸钠,反应方程式为:C6H5ONa +CO2+H2O→C6H5OH+NaCO3;
(3)乙酸与乙二醇发生酯化反应,生成二乙酸乙二酯和水,反应方程式为:2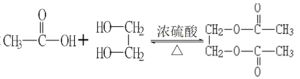 +2H2O;
+2H2O;
(4)乙醛结构中含有醛基,可与甲醇发生加成反应,反应方程式为:CH3CHO+CH3OH→CH3CH(OH)OCH3。

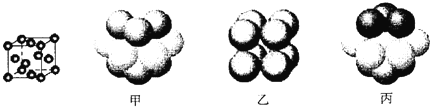
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。