题目内容
【题目】实验室模拟从海水中制备NaOH溶液,其流程如图所示,下列有关说法正确的是
![]()
A.步骤一用到的仪器有坩埚、三脚架和泥三角
B.步骤二添加NaOH的目的是除去![]()
C.步骤二的过滤操作是在加入盐酸之后
D.步骤三最后一步反应为![]()
![]()
![]()
【答案】D
【解析】
从海水中制备NaOH溶液,由流程可知,步骤一获得粗盐,为蒸发,步骤二加NaOH除去镁离子,加氯化钡除去硫酸根离子,加碳酸钠除去钙离子,再加盐酸除去过量碳酸钠和氢氧化钠,步骤三为精盐电解制备NaOH溶液,以此来解答。
A.步骤一获得粗盐,为蒸发原理,蒸发时利用蒸发皿、酒精灯等,故A错误;
B.步骤二添加NaOH的目的是除去![]() ,不是除去钙离子,氢氧化钙是微溶于水的,不是沉淀,应该用碳酸钠除去钙离子,故B错误;
,不是除去钙离子,氢氧化钙是微溶于水的,不是沉淀,应该用碳酸钠除去钙离子,故B错误;
C.因盐酸与碳酸钙、碳酸钡反应,则步骤二过滤后,再加盐酸,即过滤操作在加盐酸之前,故C错误;
D.步骤三为精盐电解制备NaOH溶液,电解反应为![]()
![]()
![]() ,故D正确;
,故D正确;
答案选D。

【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
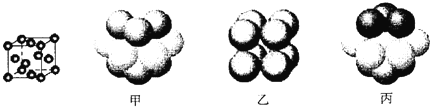
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。