题目内容
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
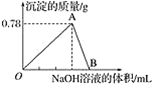
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
【答案】Al(OH)3 0.01 mol 15mL NaAlO2、NaCl 0.5mol·L-1 Al3++4OH-=![]() +2H2O
+2H2O
【解析】
本题是一道铝盐和碱反应的题目,只需牢牢抓住AlCl3+3NaOH===Al(OH)3↓+3NaCl和Al(OH)3+NaOH===NaAlO2+2H2O两个主要反应来分析即可,OA段沉淀质量在不断增加,因此是第一个反应,AB段沉淀质量开始减少,因此是AB段。
(1)向AlCl3溶液中滴加NaOH溶液时,先发生反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH===NaAlO2+2H2O,故A点沉淀为Al(OH)3,其物质的量为![]() =0.01 mol;
=0.01 mol;
(2)根据Al3++3OH-===Al(OH)3↓可知,反应至A点时消耗的n(NaOH)=3n[Al(OH)3]=0.01mol×3=0.03mol,消耗NaOH溶液的体积为![]() =0.015 L=15mL;
=0.015 L=15mL;
(3)根据AlCl3+3NaOH===Al(OH)3↓+3NaCl、Al(OH)3+NaOH===NaAlO2+2H2O可知,B点溶液中的溶质为NaAlO2、NaCl;
(4)c(AlCl3)=![]() =0.5 mol·L-1;
=0.5 mol·L-1;
(5)O点到B点总反应为Al3+转化为![]() 反应,总离子方程式为Al3++4OH-===
反应,总离子方程式为Al3++4OH-===![]() +2H2O。
+2H2O。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)不同温度下工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应的部分K值如下表。
2NH3(g)反应的部分K值如下表。
温度/℃ | 25 | 400 | 450 |
K | 5×108 | 0.507 | 0.152 |
①工业合成氨反应平衡常数表达式为K=___。
②请结合平衡常数解释,该反应为放热反应的理由___。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___。
(2)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
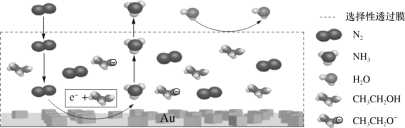
①阴极区生成NH3的电极方程式为___。
②下列说法不正确的是___(填字母序号)。
a.三氟甲磺酸锂的作用是增强导电性
b.该装置用金(Au)作催化剂目的是降低N2的键能
c.选择性透过膜可允许N2和NH3通过,防止H2O进入装置