题目内容
【题目】按要求回答下列问题:
(1)![]() 的名称为______________________。
的名称为______________________。
(2)A,B,C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为_________________________________。
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为_______(任写一种)。
”基团,则其可能的结构简式为_______(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式及名称为__________。
(3)下列是八种环状的烃类物质:
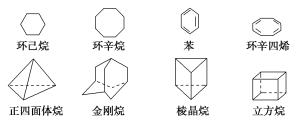
①互为同系物的有________和________(填名称),互为同分异构体的有________和________,________和________(填写名称,可以不填满,也可以再补充)。
②正四面体烷的二氯取代产物有________种;立方烷的二氯取代产物有________种;金刚烷一氯取代产物有________种。
③写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)并用系统命名法命名:___________________________________________。
(4)今有三种化合物结构如下:
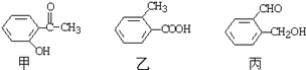
①请写出丙中含氧官能团的名称:__________________________________;
②请判断上述哪些化合物互为同分异构体:_____________________________。
【答案】2,5二甲基4乙基庚烷 ![]() CH2=CH-CH2-CH=CH-CH3,CH3-CH=CH-CH=CH-CH3,CH2=CH-HC=CH-CH2-CH3,CH2=CH-CH2-CH2-CH=CH2(任填一种) CH≡CCH2CH2CH2CH3,1-己炔、CH3C≡CCH2CH2CH3,2-己炔、CH3CH2C≡CH2CH2CH3,3-己炔 环己烷 环辛烷 苯 棱晶烷 环辛四烯 立方烷 1 3 2
CH2=CH-CH2-CH=CH-CH3,CH3-CH=CH-CH=CH-CH3,CH2=CH-HC=CH-CH2-CH3,CH2=CH-CH2-CH2-CH=CH2(任填一种) CH≡CCH2CH2CH2CH3,1-己炔、CH3C≡CCH2CH2CH3,2-己炔、CH3CH2C≡CH2CH2CH3,3-己炔 环己烷 环辛烷 苯 棱晶烷 环辛四烯 立方烷 1 3 2 ![]() (1,4-二甲苯)或
(1,4-二甲苯)或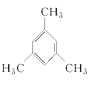 (1,3,5-三甲苯) 羟基、醛基 甲、乙、丙
(1,3,5-三甲苯) 羟基、醛基 甲、乙、丙
【解析】
(1)主链有7个碳,该物质命名为:2,5二甲基4乙基庚烷,故答案为:2,5二甲基4乙基庚烷;
(2) C6H10含2个不饱和度,含一个碳碳三键、二个碳碳双键、一个普通环和一个碳碳双键结构,且无支链或侧链,所以:
①若A为环状,则其结构简式必为:![]() ,故答案为:
,故答案为:![]() ;
;
②若B为含有双键的链状结构,其分子中不存在“=C=C=C=”基团,则B的结构简式可能为:CH2=CH-CH2-CH=CH-CH3,CH3-CH=CH-CH=CH-CH3,CH2=CH-HC=CH-CH2-CH3,CH2=CH-CH2-CH2-CH=CH2,故答案为:CH2=CH-CH2-CH=CH-CH3,CH3-CH=CH-CH=CH-CH3,CH2=CH-HC=CH-CH2-CH3,CH2=CH-CH2-CH2-CH=CH2(任填一种);
③若C为含有三键的链状结构,其可能结构为CH≡CCH2CH2CH2CH3或CH3C≡CCH2CH2CH3或CH3CH2C≡CH2CH2CH3,名称分别为:1-己炔,2-己炔,3-己炔,故答案为:CH≡CCH2CH2CH2CH3,1-己炔、CH3C≡CCH2CH2CH3,2-己炔或CH3CH2C≡CH2CH2CH3,3-己炔;
(3) ①同系物:结构相似,分子组成上相差一个或若干个CH2原子团的化合物,则环己烷(C6H12)与环辛烷(C8H16)均为环烷烃,分子组成上相差2个CH2,互为同系物;同分异构体:分子式相同,结构式不同的化合物,则苯与棱晶烷(分子式均为C6H6),环辛四烯与立方烷(分子式均为C8H8)互为同分异构体,故答案为:环己烷;环辛烷;苯;棱晶烷;环辛四烯;立方烷;
②由正四面体烷的结构可知分子中有4个碳原子和4个氢原子,分子式为C4H4,正四面体烷完全对称,只有一种氢原子,一氯代物只有1种,一氯代物中氢原子也只有1种,所以二氯代物只有1种;立方烷分子中只有一种氢原子,其一氯代物有1种,而一氯代物有3种氢原子,如图: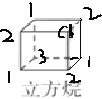 ,则立方烷的二氯代物有3种;金刚烷分子中有两种氢原子,一种是次甲基氢,一种亚甲基氢,所以其一氯代物有2种;故答案为:1;3;2;
,则立方烷的二氯代物有3种;金刚烷分子中有两种氢原子,一种是次甲基氢,一种亚甲基氢,所以其一氯代物有2种;故答案为:1;3;2;
③苯的同系物含有1个苯环,侧链为烷基,一氯代物只有两种的物质,说明只有2种氢原子,则与苯互为同系物且一氯代物只有两种的物质的结构简式为![]() ,名称为1,4-二甲苯;
,名称为1,4-二甲苯;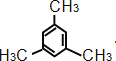 ,名称为1,3,5-三甲苯;故答案为:
,名称为1,3,5-三甲苯;故答案为:![]() 1,4-二甲苯或
1,4-二甲苯或 1,3,5-三甲苯;
1,3,5-三甲苯;
(4) ①根据结构简式可知,丙中的含氧官能团是醛基和羟基,故答案为:醛基、羟基;
②分子式相同而结构式不同的化合物互为同分异构体,所以根据结构简式可知,甲、乙、丙的分子式都是C8H8O2,但它们的结构不同,所以互为同分异构体,故答案为:甲、乙、丙。

【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
【题目】分别进行下表所示实验,实验现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 测量熔融状态下NaHSO4的导电性 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、 |
B | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X可能为浓盐酸 |
C | 将甲烷与氯气按体积比1:4混合于试管中光照 | 反应后混合气体能使润湿的石蕊试纸变红 | 生成的氯代甲烷具有酸性 |
D | 将AlCl3溶液加热蒸干 | 得到白色固体 | 白色固体成分为纯净的AlCl3 |
A.AB.BC.CD.D