题目内容
20. (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:①铁电池的负极材料是锌.
②放电时,正极发生还原(填“氧化”或“还原”)反应:已知负极反应为Zn-2e-+2OH-═Zn(OH)2,则正极反应FeO42-+3e-+4H2O═Fe(OH)3+5OH-.
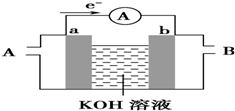
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.
①假设使用的“燃料”是甲烷,a极的电极反应式为CH4+10OH--8e-═CO32-+7H2O;b极的电极反应为2O2+4H2O+8e-═8OH-
②此电池与铅蓄电池相比,当两种电池提供相同电量时,负极所消耗物质的物质的量之比为1:4.
分析 (1)①放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应;
②放电时,正极上得电子发生还原反应,总反应方程式减去负极电极反应式即得正极反应式;
(2)①碱性条件下,电子由a流向b,则a为负极,b为正极,a电极上为甲烷失电子生成碳酸根离子;b电极上为氧气得电子生成氢氧根离子;
②根据负极上的反应,消耗负极质量减少一样多时,转移得电子的物质的量即可.
解答 解:(1)①电池的负极上发生氧化反应,正极上发生还原反应.由高铁电池放电时总反应方程式可知,负极材料应为作还原剂的Zn,故答案为:锌;
②正极上得电子发生还原反应,由电池的总反应方程式-负极反应式=正极反应式可知,正极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,
故答案为:还原;FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
(2)①碱性条件下,电子由a流向b,则a为负极,b为正极,a电极上为甲烷失电子生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;
b电极上为氧气得电子生成氢氧根离子,其电极反应式为:2O2+4H2O+8e-═8OH-;
故答案为:CH4+10OH--8e-═CO32-+7H2O;2O2+4H2O+8e-═8OH-;
②根据负极上的电极反应式:CH4+10OH--8e-═CO32-+7H2O,铅蓄电池的负极上发生的反应为:Pb-2e-+SO42-=PbSO4,
所以当两种电池提供相同电量时,负极所消耗物质的物质的量之比为:1:4,故答案为:1:4.
点评 本题考查了原电池原理等知识,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写.

练习册系列答案
相关题目
11.下列变化中,属于物理变化的是( )
| A. | 煤干馏 | B. | 石油的减压分馏 | C. | 石油裂解 | D. | 煤液化 |
8.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.0 g氟化氢所含电子数为0.1NA | |
| B. | 1 mol Na2O2 跟足量H2O反应时得到电子的数目为2NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
15.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 35Cl2与37Cl2得电子能力相同 |
5.某烃C15H24分子结构非常对称,实验证明该烃仅存在三种基团:乙烯基(CH2=CH-)、亚甲基(-CH2-)、次甲基(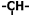 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
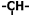 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )| A. | 2个,3个 | B. | 5个,3个 | C. | 4个,6个 | D. | 3个,6个 |