题目内容
15.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 35Cl2与37Cl2得电子能力相同 |
分析 A.同主族元素最高价含氧酸自上而下酸性减弱;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.电子排布相同的微粒,原子序数越大,半径越小;
D.同位素的化学性质相同.
解答 解:A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故A错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.电子排布相同的微粒,原子序数越大,半径越小,则S2?、Cl?、K+、Ca2+半径逐渐减小,故C错误;
D.同位素的化学性质相同,35Cl与37Cl互为同位素,所以它们形成的单质的化学性质相同,即35Cl2与37Cl2得电子能力相同,故D正确.
故选:D.
点评 本题考查元素周期表的结构及应用,把握元素周期律、周期表中的族序数、原子序数等关系为解答的关键,题目难度不大.

练习册系列答案
相关题目
6.环境污染已成为人类社会面临的重大威胁,下列各项中与环境污染无关的是( )
①温室效应;②赤潮;③酸雨;④光化学污染;⑤臭氧空洞;⑥工业含汞水排放;⑦潮汐现象; ⑧水华;⑨地方性甲状腺肿大.
①温室效应;②赤潮;③酸雨;④光化学污染;⑤臭氧空洞;⑥工业含汞水排放;⑦潮汐现象; ⑧水华;⑨地方性甲状腺肿大.
| A. | ⑥⑧ | B. | ④⑤ | C. | ①②③ | D. | ⑦⑨ |
10.下列分子式一定表示纯净物的是( )
| A. | C4H10 | B. | C3H8 | C. | C5H12 | D. | C3H7Cl |
7.用单分子油膜法测出油酸分子(视为球形)的直径后,还要下列哪一个物理量就可以计算出阿伏加德罗常数( )
| A. | 油滴的体积 | B. | 油滴的质量 | C. | 1 mol油酸的体积 | D. | 油酸的摩尔质量 |
5.下列电子排布式中,原子处于激发态的是( )
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
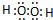 ,该分子含有极性键和非极性键(填“极性”、“非极性”)键
,该分子含有极性键和非极性键(填“极性”、“非极性”)键
 .
.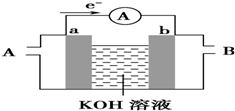 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题: