题目内容
【题目】已知: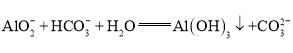 。向含0.01 mol
。向含0.01 mol ![]() 和0.02 mol NaOH的稀溶液中缓慢通入CO2,溶液中,
和0.02 mol NaOH的稀溶液中缓慢通入CO2,溶液中,![]() 随通入的
随通入的![]() 的变化如图,下列对应关系正确的是( )
的变化如图,下列对应关系正确的是( )
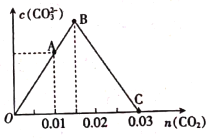
A.A点:![]()
B.B点:![]()
C.C点:![]()
D.O点:![]()
【答案】B
【解析】
向含0.01mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入CO2,首先进行的反应为![]() ,0.02mol NaOH消耗0.01mol CO2,生成0.01mol Na2CO3,故A点溶液的的溶质为0.01mol Na2CO3和0.01mol NaAlO2;然后发生反应:
,0.02mol NaOH消耗0.01mol CO2,生成0.01mol Na2CO3,故A点溶液的的溶质为0.01mol Na2CO3和0.01mol NaAlO2;然后发生反应:![]() ,0.01mol NaAlO2消耗0.005molCO2,生成0.005molNa2CO3,故B点溶液的溶质为Na2CO3;继续通入CO2,发生反应:
,0.01mol NaAlO2消耗0.005molCO2,生成0.005molNa2CO3,故B点溶液的溶质为Na2CO3;继续通入CO2,发生反应:![]() ,前两个阶段共生成0.015mol Na2CO3,则该反应会消耗0.015molCO2,生成0.03mol NaHCO3,故C点溶液的溶质为NaHCO3,据此分析解答。
,前两个阶段共生成0.015mol Na2CO3,则该反应会消耗0.015molCO2,生成0.03mol NaHCO3,故C点溶液的溶质为NaHCO3,据此分析解答。
A. 由以上分析知,A点溶液的的溶质为0.01mol Na2CO3和0.01mol NaAlO2,CO32-和AlO2-均发生水解,由物料守恒可知,A点:![]() ,故A错误;
,故A错误;
B. 由以上分析知,B点溶液的溶质为Na2CO3,Na2CO3溶液中存在CO32-的水解平衡,CO32- + H2OHCO3- + OH-、HCO3- +H2OH2CO3 + OH-,同时存在水的电离,又水解是微弱的,故B点:![]() ,故B正确;
,故B正确;
C. 由以上分析知,C点溶液的溶质为NaHCO3,由电荷守恒知,C点:![]() ,故C错误;
,故C错误;
D. O点未通入CO2,溶液的溶质为0.01 mol ![]() 和0.02 mol NaOH,故O点:
和0.02 mol NaOH,故O点: ![]() ,故D错误;
,故D错误;
故选B。

【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
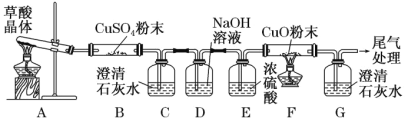
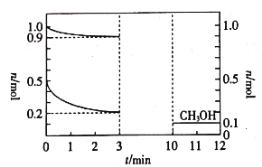
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
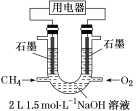
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。