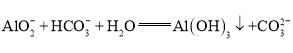题目内容
【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
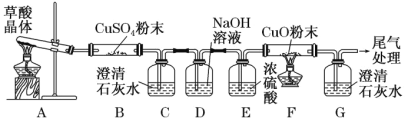
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。
【答案】BD 吸收CO2气体 F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊 两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快 MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快 2![]() +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 酸式 33.5%
+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 酸式 33.5%
【解析】
(1)电离常数越大其酸性越强,根据强酸制取弱酸判断;
(2)氢氧化钠是碱能吸收酸性氧化物;一氧化碳具有还原性,二氧化碳能使澄清石灰水变浑浊;
(3)高锰酸钾具有氧化性,能氧化还原性物质,硫酸锰具有催化作用,加快反应速率;
(4)①酸式滴定管能量取酸性溶液;
②根据高锰酸钾计算草酸钠的纯度。H2C2O4+![]() =
=![]() +
+![]()
(1)根据电离常数知酸性强弱顺序是:H2C2O4>![]() >H2CO3>
>H2CO3>![]() ,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子,故选BD;
,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子,故选BD;
(2)氢氧化钠是强碱能吸收酸性氧化物二氧化碳,一氧化碳具有还原性,能还原黑色的氧化铜生成红色的铜,同时自身被氧化生成二氧化碳,二氧化碳使澄清的石灰水变浑浊,所以看到的现象是:F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊,
故答案为:吸收CO2气体;F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊;
(3)看到的现象是两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快;通过对比实验知,硫酸锰是该反应的催化剂,加入催化剂能加快反应速率;该反应中高锰酸根离子被还原生成锰离子,草酸被氧化生成二氧化碳,离子反应方程式为:2![]() +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
故答案为:两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快;MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快;2![]() +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(4)①高锰酸钾溶液呈酸性且具有强氧化性,易腐蚀橡胶,应该用酸式滴定管量取,故答案为:酸式;
②设草酸钠的质量分数为x,

x=![]() ×100%=33.5%,
×100%=33.5%,
答:草酸钠的质量分数为33.5%。
故答案为:33.5%;

【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
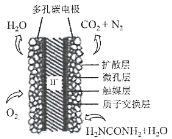
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。