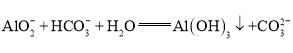题目内容
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
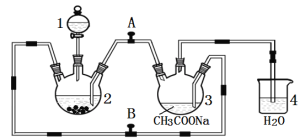
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
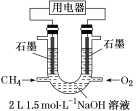
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
【答案】CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ·mol-1 ② CH4-8e-+10OH-=CO32-+7H2O CH4+2O2+Na2CO3=2NaHCO3+H2O c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ![]() mol·L-1·min-1 bde 200℃ KQ=KM>KN 75%
mol·L-1·min-1 bde 200℃ KQ=KM>KN 75%
【解析】
(1)由盖斯定律计算;
(2)从原料和能量角度进行分析;
(3)由于燃料电池中电解液(氢氧化钠溶液)中n(NaOH)=3 mol,因此燃料电池放电时,当负极消耗标准状况下甲烷体积不同时,负极反应式不同,由消耗甲烷体积推断发生的反应和生成物,据此进行分析;
(4)①由题意知产生1 mol NH3,放出46.1 kJ的热量,结合容器Ⅰ中放出的热量可得其中反应生成的氨气的物质的量,求出用氨气表示的反应速率,由反应方程式的化学计量数关系知,相同时间内用氢气表示的反应速率是氨气的1.5倍,可得用氢气表示的反应速率v(H2);
②a.根据等效平衡的思想,判断平衡移动的方向;
b.根据等效平衡的思想,判断平衡移动的方向,进而判断容器Ⅱ中Q范围;
c.由于两容器初始时反应物浓度不等,故化学反应速率不等;
d.根据等效平衡的思想,判断平衡移动的方向,进行分析;
e.容器Ⅱ相当于在容器Ⅰ的基础上加压,其反应物浓度高,反应速率快;
(5)①合成氨反应是体积减小的放热反应,因此温度高反应速率快,但达到平衡时氨的含量低,增加压强达到平衡时氨的含量变大,因此在坐标图中向横坐标作垂线交于3个曲线,根据同压下不同温度时平衡时氨的含量,可以判断曲线的温度高低;合成氨反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的NH3的物质的量分数最高,其反应温度应相对最低;
②Q、M点的温度相等(均为400 ℃),平衡常数相等,N点在温度为600 ℃的曲线上,合成氨是放热反应,温度越高平衡常数越小;
③在M点NH3的物质的量分数为60%,又按n(N2):n(H2)=1:3投料,设氢气的转化率为x,根据化学反应的物质的量关系进行计算。
(1)由盖斯定律,将反应①×2-③得:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1;
(2)题给3个反应生产水煤气,从原料角度看都易得,但从能量角度看,反应①和③是吸热反应,反应②是放热反应,所以反应②比较适合应用于生产;
(3)由于燃料电池中电解液(氢氧化钠溶液)中n(NaOH)=3 mol,因此燃料电池放电时,当负极消耗标准状况下甲烷0<V≤33.6 L时,即生成n(CO2)≤1.5 mol,生成碳酸钠,负极反应式为CH4-8e-+10OH-=CO![]() +7H2O;当消耗标准状况下甲烷33.6 L<V≤67.2 L时,生成物Na2CO3转化为NaHCO3,总电池反应式可写为CH4+2O2+Na2CO3=2NaHCO3+H2O;V=44.8 L时,溶液中电解质为物质的量相等的碳酸钠和碳酸氢钠的混合溶液,水解显碱性,但由于碳酸钠水解程度大于碳酸氢钠,因此溶液中离子浓度关系为c(Na+)>c(HCO
+7H2O;当消耗标准状况下甲烷33.6 L<V≤67.2 L时,生成物Na2CO3转化为NaHCO3,总电池反应式可写为CH4+2O2+Na2CO3=2NaHCO3+H2O;V=44.8 L时,溶液中电解质为物质的量相等的碳酸钠和碳酸氢钠的混合溶液,水解显碱性,但由于碳酸钠水解程度大于碳酸氢钠,因此溶液中离子浓度关系为c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)>c(H+);
)>c(OH-)>c(H+);
(4)①由题意知产生1 mol NH3,放出46.1 kJ的热量,结合容器Ⅰ中放出的热量可得,其中反应生成的氨气的物质的量为![]() =0.8 mol,则用氨气表示的反应速率为
=0.8 mol,则用氨气表示的反应速率为![]() mol·L-1·min-1,由反应方程式的化学计量数关系知,相同时间内用氢气表示的反应速率是氨气的1.5倍,则用氢气表示的反应速率v(H2)=
mol·L-1·min-1,由反应方程式的化学计量数关系知,相同时间内用氢气表示的反应速率是氨气的1.5倍,则用氢气表示的反应速率v(H2)=![]() mol·L-1·min-1;
mol·L-1·min-1;
②a.由于容器Ⅰ和Ⅱ容积相等,但初始加入的反应物的量后者是前者的2倍,相当于增大压强,而合成氨反应是气体体积减小的反应,增大压强平衡向右移动,因此,平衡时容器Ⅰ中氢气的体积分数大于容器Ⅱ,a项错误;
b.反应达到平衡状态时容器Ⅱ中Q>2×36.88,b项正确;
c.由于两容器初始时反应物浓度不等,故化学反应速率不等,c项错误;
d.压强大的容器Ⅱ中反应物的转化率大,d项正确;
e.容器Ⅱ相当于在容器Ⅰ的基础上加压,其反应物浓度高,反应速率快,因此容器Ⅱ比容器Ⅰ先达到平衡状态,e项正确;故答案选bde;
(5)①合成氨反应是体积减小的放热反应,因此温度高反应速率快,但达到平衡时氨的含量低,增加压强达到平衡时氨的含量变大,因此在坐标图中向横坐标作垂线交于3个曲线,根据同压下不同温度时平衡时氨的含量,可以判断曲线的温度高低;合成氨反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的NH3的物质的量分数最高,其反应温度应相对最低,由此可判断曲线a对应的温度是200 ℃;
②Q、M点的温度相等(均为400 ℃),平衡常数相等,N点在温度为600 ℃的曲线上,合成氨是放热反应,温度越高平衡常数越小,因此有:KQ=KM>KN;
③在M点NH3的物质的量分数为60%,又按n(N2):n(H2)=1:3投料,设氢气的转化率为x,则平衡时各物质的量为n(N2)=(1-x) mol,n(H2)=3×(1-x) mol,n(NH3)=2x mol,则有![]() ×100%=60%,得x=0.75,即H2的转化率为75%。
×100%=60%,得x=0.75,即H2的转化率为75%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案