题目内容
10.已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
分析 A.由图可知,40℃之前,温度高反应速率加快,40℃之后温度高,变色时间越长;
B.a点时间为80s,浓度变化量为$\frac{0.02mol/L×0.01L}{0.05L}$=0.004mol/L;
C.b、c点对应的反应原理及温度不同;
D.结合55℃时,没有出现蓝色分析.
解答 解:A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,故A正确;
B.a点时间为80s,浓度变化量为$\frac{0.02mol/L×0.01L}{0.05L}$=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10-5mol•L-1•s-1,故B正确;
C.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32-+2IO3-+2H+=5SO42-+I2+H2O,而图中c点的反应原理为2IO3-+5SO2+4H2O=5SO42-+I2+8H+,则图中b、c点对应的反应原理不一样,且温度不同,故反应速率不同,故C错误;
D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故D正确.
故选C.
点评 本题考查化学反应速率的影响因素,侧重图象分析及温度对反应的影响,注意不同温度下均可被过量KIO3氧化,注重分析能力和解决问题能力的考查,题目难度较大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
20.下列实验过程中产生的现象与对应的图象不相符合的是( )
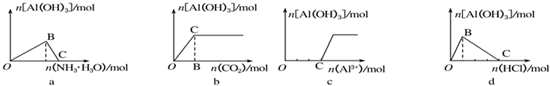
①在AlCl3溶液中滴加氨水至过量
②向Na[Al(OH)4]溶液中逐渐通入二氧化碳至过量
③向Na[Al(OH)4]溶液中滴加稀盐酸至过量边滴边振荡
④向NaOH溶液中滴加AlCl3溶液至过量边滴边振荡.

①在AlCl3溶液中滴加氨水至过量
②向Na[Al(OH)4]溶液中逐渐通入二氧化碳至过量
③向Na[Al(OH)4]溶液中滴加稀盐酸至过量边滴边振荡
④向NaOH溶液中滴加AlCl3溶液至过量边滴边振荡.
| A. | a① | B. | b② | C. | c④ | D. | d③ |
1.萘(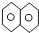 )是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )
)是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )
 )是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )
)是最简单的稠环芳香烃.下列关于萘的说法中正确的是( )| A. | 萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 1mol萘最多可与6mol H2加成 | |
| C. | 萘的一氯代物有2种,二氯代物有10种 | |
| D. | 萘属于苯的同系物 |
5.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X>R | |
| C. | Z的单质能与Y的某些化合物发生置换反应 | |
| D. | R的最高价氧化物对应水化物分子为HRO3或H3RO4 |
15.化学与人类生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
2.将一定质量的镁铜合金加入到100mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体.反应后向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀质量比原合金质量增加5.1g;则下列有关叙述中不正确的是( )
| A. | 开始加入合金的总物质的量为0.15mol | |
| B. | 生成NO气体体积在标准状况下为2.24L | |
| C. | 生成沉淀完全时消耗NaOH溶液体积为100mL | |
| D. | 原硝酸物质的量浓度为1mol/L |
19.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角应为( )
| A. | 60° | B. | 90° | C. | 120° | D. | 180° |
20.下列有关化学键类型的叙述正确的是( )
| A. | 全部由非金属元素构成的化合物中肯定不存在离子键 | |
| B. | 所有物质中都存在化学键 | |
| C. | 已知乙炔的结构式为CH≡CH,则乙炔中σ键和π键之比为3:2 | |
| D. | 乙炔分子中只存在σ键,不存在π键 |