题目内容
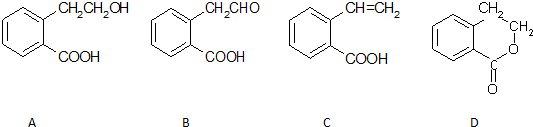
8.下列4组原子序数的元素,彼此间能形成共价键的是( )| A. | 8和11 | B. | 8和12 | C. | 15和17 | D. | 12和16 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,以此解答该题.
解答 解:A.8号元素是O元素,11号元素是Na元素,钠离子和氧离子或过氧根离子之间存在离子键,故A不选;
B.8号元素是O元素,12号元素是Mg元素,镁离子和氧离子之间存在离子键,故B不选;
C.15号元素是P,17号元素是Cl,磷元素和氯元素之间易形成共价键,故C选;
D.12号元素是Mg,16号元素是S,Mg元素和S元素之间易形成离子键,故D不选.
故选C.
点评 本题考查了化学键的形成,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大,注意金属元素和非金属元素之间不一定形成离子键,如氯化铝.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
18.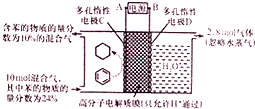 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 2.8g[CH2 CH2]n 中含有的碳原子数为0.2NA | |
| C. | 1mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
16.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
3.已知元素的原子序数,可以推知原子的①中子数 ②核电荷数 ③核外电子数 ④在周期表中的位置,其中正确的是( )
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
13.将X、Y不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变.X、Y可能是( )
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
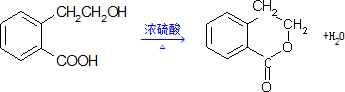 .
. .
.