题目内容
7.如图所示的实验,不能达到实验目的是( )| A | B | C | D |
 |  |  |  |
| 证明温度对平衡移动的影响验证 | 实现了化学能与电能相互转化 | 验证铁钉发生吸氧腐蚀 | 制备少量的氧气 |
| A. | A | B. | B | C. | C | D. | D |
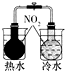
分析 A.已知2NO2?N2O4△H<0,升高温度或降低温度,该反应都发生平衡移动导致气体颜色发生变化;
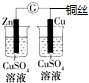
B.该装置没有构成闭合回路,所以不能形成原电池;
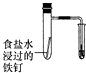
C.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升;
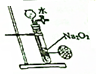
D.过氧化钠为粉末固体,隔板不能使固体与液体分离.
解答 解:A.已知2NO2?N2O4△H<0,升高温度或降低温度,该反应都发生平衡移动导致气体颜色发生变化,温度不同导致两个烧瓶中气体颜色不同,所以可以实现实验目的,故A不选;
B.该装置没有构成闭合回路,所以不能形成原电池,所以不能实现化学能转化为电能,故B选;
C.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升,所以可以实现实验目的,故C不选;
D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D选;
故选BD.
点评 本题考查化学实验方案评价,为高频考点,涉及化学平衡影响因素、原电池原理、金属的腐蚀与防护、气体制备等知识点,把握反应原理及装置图为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大,易错选项是D.

练习册系列答案
相关题目
19.下列离子方程式书写正确的是( )
| A. | 金属铝溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ | |
| B. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
12.强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ•mol-1,
又知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系是( )
H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ•mol-1,
又知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系是( )
| A. | Q2>Q3>Q1 | B. | Q2>Q1>Q3 | C. | Q1=Q2=Q3 | D. | Q2=Q3>Q1 |
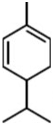 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
 2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )