题目内容
19.下列离子方程式书写正确的是( )| A. | 金属铝溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ | |
| B. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
分析 A.离子方程式两边负电荷不相等,违反了电荷守恒;
B.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水;
C.漏掉了生成碳酸钡沉淀的反应;
D.铁与稀硝酸反应不会生成氢气.
解答 解:A.金属铝溶于氢氧化钠溶液中生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故A错误;
B.铜与稀硝酸反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故B正确;
C.硫酸铵溶液与氢氧化钡溶液反应生成碳酸钡沉淀和一水合氨,正确的离子方程式为:2NH4++Ba2++2OH-+CO32-=BaCO3↓+2NH3•H2O,故C错误;
D.铁与稀硝酸反应生成NO气体,如:铁过量时生成硝酸亚铁,反应为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
12.下列表述正确的是( )
| A. | 氢氧根离子的电子式是 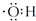 | |
| B. | 二氧化碳分子的比例模型是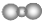 | |
| C. | 芳香烃的组成通式是CnH2n-6(n≥6) | |
| D. | 12C和14C的原子结构示意图均可表示为 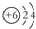 |
11.下列说法错误的是( )
| A. | 微粒半径:S<S2-<K | B. | 稳定性:H2O>H2S>PH3 | ||
| C. | 酸性:H3PO4<HNO3<HClO4 | D. | 沸点:HF<HCl<HBr<HI |
7.下列关于氮族元素从N→Bi的性质递变不正确的是( )
| A. | 元素非金属性:逐渐减弱 | B. | 单质氧化性:逐渐减弱 | ||
| C. | 氢化物稳定性:逐渐增强 | D. | 最高价含氧酸酸性:逐渐减弱 |
14.在一可变容积的容器中进行下列反应:H2(g)+I2(g)?2HI(g)达平衡,当温度不变时,增大压强,容器内气体颜色加深,对此正确的说法是( )
| A. | 平衡向生成I2的方向移动 | B. | HI分子减少 | ||
| C. | I2的分子数增多 | D. | I2的浓度增大 |
11.实验室有下列试剂:①NaOH溶液 ②水玻璃 ③Na2S溶液 ④NH4Cl溶液 ⑤浓H2SO4,其中必须用带橡胶塞的试剂瓶保存的是( )
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ①②③ |
8.下列化学式,只表示一种纯净物的是( )
| A. | C2H6O | B. | C2H4 | C. | C | D. | C4H10 |