题目内容
19.相同物质的量的CO2和O2,其所含原子数目之比为3:2,所含氧原子数目之比为1:1,质量相同的CO2和O2,其物质的量之比为8:11;相同条件下,同体积的CO2和O2其分子数之比为1:1.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成计算.
解答 解:由分子式可知,相同物质的量的CO2和O2,其所含原子数目之比为3:2,所含氧原子数目之比为1:1,质量相同的CO2和O2,其物质的量之比为 $\frac{m}{44}:\frac{m}{32}$=8:11;相同条件下,同体积的CO2和O2其分子数之比为1:1,
故答案为:3:2; 1:1;8:11; 1:1
点评 本题考查物质的量有关计算、物质中原子数目的计算等,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
4.a的金属活动性比氢强,b为碳棒,关于下列装置的说法中不正确的是( )
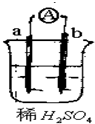

| A. | a发生氧化反应,b发生还原反应 | B. | 碳棒上有气体逸出 | ||
| C. | 导线上有电流,电流方向从a→b | D. | 反应后a极质量减小 |
11.下列反应的离子方程式正确的是( )
| A. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 过量的CO2通入Na[Al(OH)4]-溶液中:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- |
8.制取漂白液的化学方程式是:3S+6NaOH═2Na2S+Na2SO3+3H2O,该反应中氧化剂与还原剂的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
9.下列有关电解原理的说法不正确的是( )
| A. | 电解饱和食盐水时,一般用铁作阳极,碳作阴极 | |
| B. | 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 | |
| C. | 对于冶炼像钠、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 电解精炼铜时,用纯铜板作阴极,粗铜板作阳极 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标