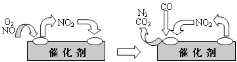
题目内容
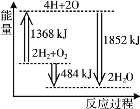
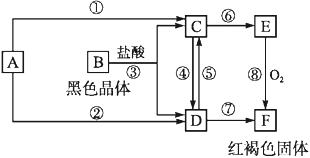
【题目】已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
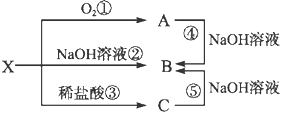
(1)写出以下反应的离子方程式:
②___________________________;
④___________________________。
(2)确定化学式B_______ X_______
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O NaAlO2 Al
【解析】
既能和NaOH溶液反应,又能和稀盐酸反应的金属X是Al,X、A、B、C含同一种元素,故A为Al2O3,B为NaAlO2,C为AlCl3。
经分析,X为Al,A为Al2O3,B为NaAlO2,C为AlCl3,则:
(1)反应②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;反应④的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(2) B为NaAlO2,X为Al。

【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
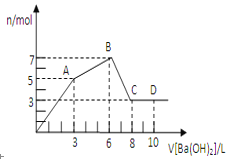
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。

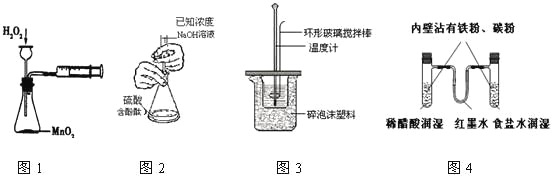
【题目】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
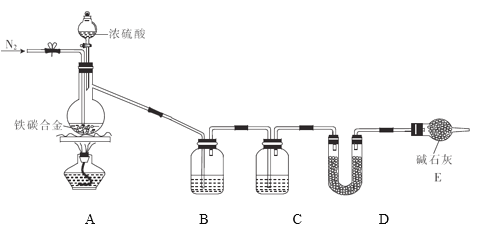
(1)装置A中发生的反应除外![]() ,还有________________。
,还有________________。
(2)请完成下列表格:
装置代号 | B | C | D |
所盛试剂 | 酸性 | ①________ | ②____________ |
装置作用 | ③_____________ | 干燥气体 | ④___________ |
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______,若缺少E装置,则所测碳的质量分数_________(填“偏高”“偏低”或“无影响”)。
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。