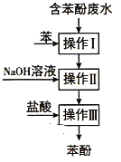
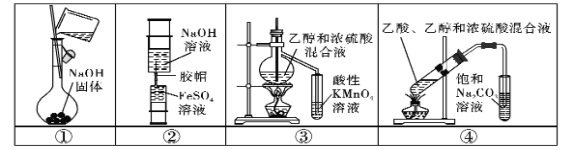
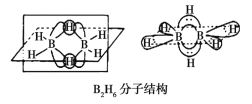
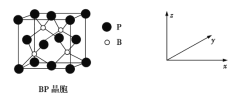
题目内容
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
【答案】D
【解析】
依据得失电子守恒,计算表现氧化性的HNO3的物质的量,HNO3总量减去表现氧化性的硝酸量,即可得到溶液中NO3-的量。
FeS中,Fe由+2价升高到+3价,S由-2价升高到+6价,a mol FeS共失电子9amol;
FeO中,Fe由+2价升高到+3价,b mol FeO共失电子b mol;
HNO3中,N由+5价降为+2价,1molHNO3共得电子3mol。
设表现氧化性的HNO3的物质的量为x
则 9a+b=3x x=![]()
从而得出反应后溶液中NO3-的量为(cV-![]() )mol。
)mol。
答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。