题目内容
5.某工业废液中含有Cu2+、Mg2+、Zn2+等离子,为将其回收利用,再采用了如下工艺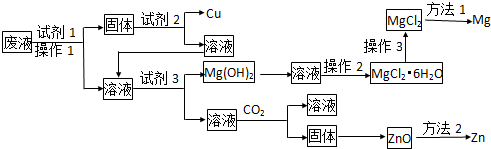
已知Zn(OH)2的性质与Al(OH)3相似所用试剂在下列试剂中选择
①铁粉 ②锌粉 ③稀HNO3 ④稀H2SO4 ⑤稀HCl ⑥稀氨水 ⑦NaOH溶液 ⑧石灰水
请回答下列问题:
(1)试剂1、试剂2、试剂3分别可以是②、⑤、⑦(填编号)
(2)操作2是蒸发浓缩、冷却结晶、过滤
(3)操作3是在HCl气流中加热
(4)加过量CO2时发生反应的离子方程式ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
(5)在金属冶炼方法中方法1是电解法方法2是还原剂法.
分析 废液中含有Cu2+、Mg2+、Zn2+等离子,加入试剂1得到固体,且固体中加入试剂2得到Cu,故固体中含有Cu,那么试剂1是能还原铜离子的物质,结合题目得知,为锌粉,试剂2是可以溶解过量锌粉,且不能溶解Cu的物质,可以是稀硫酸或稀盐酸,由此流程可知最终得到盐酸盐,为不引入新杂质,故选择稀盐酸,操作1后的溶液中含有Mg2+和Zn2+;加入试剂3生成氢氧化镁沉淀,故试剂3为氢氧化钠,依据“Zn(OH)2的性质与Al(OH)3相似”得知过量的氢氧化钠与锌离子生成溶液,此溶液中通入二氧化碳气体生成氢氧化锌,氢氧化锌加热分解生成ZnO,据此解答各小题即可.
解答 解:(废液中含有Cu2+、Mg2+、Zn2+等离子,加入试剂1得到固体,且固体中加入试剂2得到Cu,故固体中含有Cu,那么试剂1是能还原铜离子的物质,结合题目得知,为锌粉,试剂2是可以溶解过量锌粉,且不能溶解Cu的物质,可以是稀硫酸或稀盐酸,为不引入新杂质,故选择稀盐酸,操作1后的溶液中含有Mg2+和Zn2+;加入试剂3生成氢氧化镁沉淀,故试剂3为氢氧化钠,依据“Zn(OH)2的性质与Al(OH)3相似”得知过量的氢氧化钠与锌离子生成溶液,此溶液中通入二氧化碳气体生成氢氧化锌,氢氧化锌加热分解生成ZnO,
(1)由分析可知:试剂1、试剂2、试剂3分别可以是②、⑤、⑦,故答案为:②;⑤;⑦;
(2)操作2是从溶液中得到固体,那么次操作是蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩;冷却结晶;过滤;
(3)由于氯化镁为强酸弱碱盐,镁离子容易水解,故应在HCl气流中加热以防止镁离子水解,故答案为:在HCl气流中加热;
(4)偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,据此得出氢氧化锌与过量的氢氧化钠反应生成ZnO22-(由于Zn为+2价,据此得出此离子),此离子与二氧化碳反应生成氢氧化锌沉淀,故离子反应方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(5)活泼金属采用电解法冶炼,较活泼金属采用热还原法冶炼,由于Mg很活泼,故采用电解法,Z你n较活泼,采用还原剂法,故答案为:电解法;还原剂法.
点评 本题主要考查的是无机流程中的物质的分离和提纯,涉及化学试剂的选取、铝的两性类比考查、活泼金属的冶炼方法等,综合性较强,难度较大.

 阅读快车系列答案
阅读快车系列答案
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是不能,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(5)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶,过滤.利用滤渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |




 .
. Al(OH)3+3H+(用离子方程式表示).
Al(OH)3+3H+(用离子方程式表示).