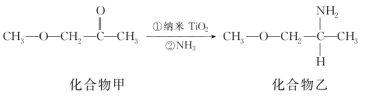
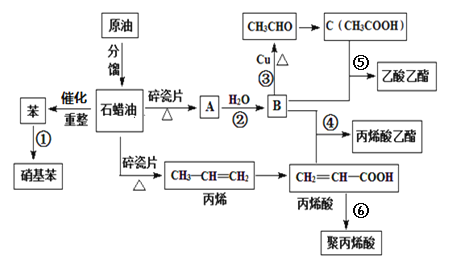
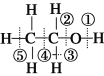
��Ŀ����
����Ŀ���״���ˮ�������������ֱ������ȼ�ϵ�ء��ش��������⣺
(1)��֪�״��ֽⷴӦ��CH3OH(g)![]() CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
ˮ�����任��Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
��CH3OH(g)��H2O(g)![]() CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
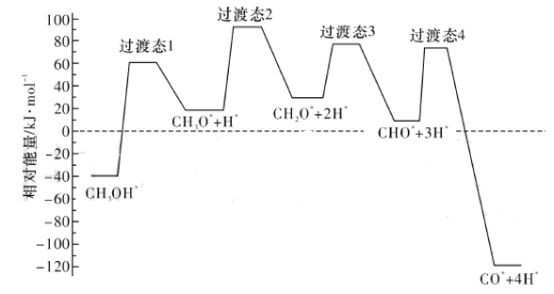
(2)��ѧ��ͨ���ܶȷ��������о��״���ˮ�����������ⷴӦ����ʱ���õ��״���Pd(III)���淢������ʱ�ĸ�·������������Ĺ�ϵ��ͼ��ʾ�����и���Pd(III)�����������*��ע���������л����С�ķ�Ӧ����ʽΪ_____________________________________________��
(3)��0.1MPa�£����ܽ�����Ϊ1 mol��n(CH3OH)��n(H2O)��1��1.3�Ļ���������һ�����ܱ������з�Ӧ��
��ʵ����ˮ�����任��Ӧ���������¶ȵ����������½���ԭ����____________________��
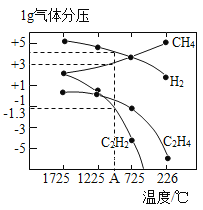
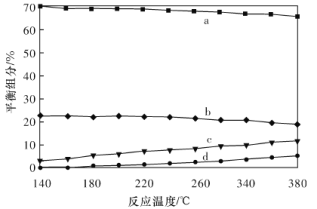
��ƽ��ʱ�����CH3OH�ĺ����ڸ����¶ȷ�Χ�ڼ�С��H2��H2O(g)��CO��CO2������ֵĺ����뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�Ϊ________��________��
(4)573.2Kʱ����һ�����ܱ������г���5.00 MPa CH3OHʹ��ֽ⣬t h���ƽ��ʱH2�����ʵ�������Ϊ60%����t h��v(CH3OH)��_____MPa��h��1�����ѹƽ�ⳣ��Kp��_____MPa2��
���𰸡�+49.44 CH2O*+2H*=CHO*+3H*����CH2O*=CHO*+H*�� ���¶����ߣ������Խ��� CO2 H2O��g�� ![]() 168.75
168.75
��������
��1���״��ֽⷴӦ��CH3OH(g)![]() CO(g)��2H2(g) ��H1����90.64 kJ��mol��1����
CO(g)��2H2(g) ��H1����90.64 kJ��mol��1����
ˮ�����任��Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.20 kJ��mol��1����
CO2(g)��H2(g) ��H2����41.20 kJ��mol��1����
����+�ڣ��������CH3OH(g)��H2O(g)![]() CO2(g)��3H2(g) ��H3��=+90.64 kJ��mol��1+��-41.20 kJ��mol��1��=+49.44 kJ��mol��1���ʴ�Ϊ��+49.44��
CO2(g)��3H2(g) ��H3��=+90.64 kJ��mol��1+��-41.20 kJ��mol��1��=+49.44 kJ��mol��1���ʴ�Ϊ��+49.44��
��2�����Ϊ��Ӧ��������������̬����֮���ͼ�п��Կ���������̬3�����ķ�Ӧ�����С����Ӧ��Ϊ��CH2O*+2H*��������Ϊ��CHO*+3H*���ʷ�Ӧ����ʽΪCH2O*+2H*=CHO*+3H*����Ϊ2H*��Ӧǰ�������ڴ������棬δ���뷴Ӧ���ʷ�Ӧʵ��ΪCH2O*=CHO*+H*���ʴ�Ϊ��CH2O*+2H*=CHO*+3H*����CH2O*=CHO*+H*����
��3����Ϊ�¶����ߣ���Ӧ����Ӧ�ӿ죬��ͼ�����ʼ�С����Ȼ�����¶ȵ�Ӱ�죬ֻ��Ϊ�����Ļ��Խ��ͣ��ʴ�Ϊ�����¶����ߣ������Խ��ͣ�
�ڶ��ڷ�ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����H��0��������������ʱ�������¶ȣ�ƽ�������ƶ�����CO��H2O�ĺ���������CO2��H2�ĺ�������С������ͼ����Ϣ���ɳ�����֪��a��b���߷ֱ��ӦCO2��H2��c��d�������ӦCO��H2O��g�������ݷ�Ӧ����ʽ��֪���÷�Ӧ��ʼʱ��n��H2����n��CO2����n��H2O����n��CO����ƽ��ʱ������Ȼ��H2��CO2��H2O��CO����a��b��c��d���߷ֱ��ӦH2��CO2��H2O��g����CO������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�ΪCO2��H2O��g�����ʴ�Ϊ��CO2��H2O��g����
CO2��g��+H2��g����H��0��������������ʱ�������¶ȣ�ƽ�������ƶ�����CO��H2O�ĺ���������CO2��H2�ĺ�������С������ͼ����Ϣ���ɳ�����֪��a��b���߷ֱ��ӦCO2��H2��c��d�������ӦCO��H2O��g�������ݷ�Ӧ����ʽ��֪���÷�Ӧ��ʼʱ��n��H2����n��CO2����n��H2O����n��CO����ƽ��ʱ������Ȼ��H2��CO2��H2O��CO����a��b��c��d���߷ֱ��ӦH2��CO2��H2O��g����CO������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�ΪCO2��H2O��g�����ʴ�Ϊ��CO2��H2O��g����
��4������CH3OH��ѹǿ�仯��Ϊx���г�����ʽ��

![]() ��x=3.75Mpa��v��CH3OH��=
��x=3.75Mpa��v��CH3OH��=![]() =
=![]() MPa��h��1��Kp=
MPa��h��1��Kp=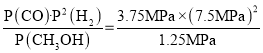 =168.75��MPa��2��
=168.75��MPa��2��
�ʴ�Ϊ��![]() ��168.75��MPa��
��168.75��MPa��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�