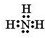题目内容
16.下列叙述不正确的是( )| A. | 金刚石晶胞(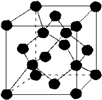 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 | |
| B. | 二氧化硅晶体中最小环上的氧原子数、氯化铯晶体中氯离子的配位数均为6 | |
| C. | 锌晶胞 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 | |
| D. | 33g CH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol. |
分析 A、根据晶胞的结构,利用均摊法计算各晶胞中所含有的原子数;
B、根据氯化铯晶胞的结构可知,氯离子的配位数为8;
C、根据锌晶胞结构可知,锌原子的配位数为12,氯化钠晶体中以晶胞顶点上的钠离子为例,距离该钠离子最近且相等的钠离子分布在晶胞的面心上,共有12个;
D、每个 CH≡C-CH=CH-CH3分子中所含的π键数为3,石墨中每个碳原子平均占有1.5mol碳碳键,据此计算;
解答 解:A、根据晶胞的结构,利用均摊法可知金刚石晶胞中含有碳原子数为4+$6×\frac{1}{2}+8×\frac{1}{8}$=8,碘晶体晶胞中平均含有碘分子数为$6×\frac{1}{2}+8×\frac{1}{8}$=4,所以晶胞中含有的原子数均为8,故A正确;
B、根据氯化铯晶胞的结构可知,氯离子的配位数为8,故B错误;
C、根据锌晶胞结构可知,锌原子的配位数为12,氯化钠晶体中以晶胞顶点上的钠离子为例,距离该钠离子最近且相等的钠离子分布在晶胞的面心上,共有12个,故C正确;
D、每个 CH≡C-CH=CH-CH3分子中所含的π键数为3,33g CH≡C-CH=CH-CH3的物质的量为0.5mol,含有π键为1.5mol,石墨中每个碳原子平均占有1.5mol碳碳键,12g石墨含有碳原子数为1mol,所以12g石墨中所含的碳碳键数均为1.5mol,故D正确;
故选B.
点评 本题主要考查常见晶胞的结构,学会运用均摊法进行计算,中等难度,答题时注意熟记常见晶胞的空间结构.

练习册系列答案
相关题目
7.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- | |
| B. | c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 在加入铝粉后能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
4.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为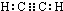 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极发生的电极反应式为O2+2H2O+4e-=4OH-;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
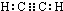 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极发生的电极反应式为O2+2H2O+4e-=4OH-;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
1.乙酸乙酯和丙酸的混合物中氧元素质量分数为30%,则氢元素的质量分数为( )
| A. | 40% | B. | 30% | C. | 10% | D. | 20% |
8.某有机物 ,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的
,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的
该物质恰好反应(可加热),则消耗此三种物质的物质的量之比为( )
 ,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的
,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的该物质恰好反应(可加热),则消耗此三种物质的物质的量之比为( )
| A. | 6:4:5 | B. | 3:2:3 | C. | 3:2:2 | D. | 1:1:1 |
5.下列有机化合物中沸点最高的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙酸 | D. | 乙醇 |
6.下列叙述肯定正确的是( )
| A. | 在离子晶体中不可能存在非极性键 | |
| B. | 在共价化合物的分子晶体中不可能存在离子键 | |
| C. | 在极性分子中不可能存在非极性键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.