题目内容
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)IO3-离子的立体构型的名称为____,中心原子的杂化方式为____。
(2)HIO4的酸性强于HIO3,其原因为____。
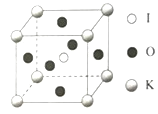
(3)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为____nm,与K紧邻的O的个数为____。
【答案】三角锥形 sp3杂化 HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强 ![]() ×0.446nm或0.386nm 12
×0.446nm或0.386nm 12
【解析】
(1)I3+的中心碘原子的价层电子对数为![]() ,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形,中心原子采用sp3杂化,故答案为:三角锥形;sp3杂化;
,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形,中心原子采用sp3杂化,故答案为:三角锥形;sp3杂化;
(2)HIO4中I的正电性更高,导致I—O—H中0的电子向I偏移,更容易电离出H+,酸性更强,所以HIO4的酸性强于HIO3,故答案为:HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强;
(5)由晶胞图可知,K原子处于顶角,I原子处于体心,两者的最近距离为立方体体对角线的一半,即![]() ×0.446nm或0.386nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子,故答案为:
×0.446nm或0.386nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子,故答案为:![]() ×0.446nm或0.386nm;12。
×0.446nm或0.386nm;12。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A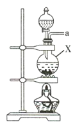 B
B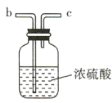
C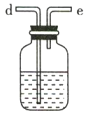 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
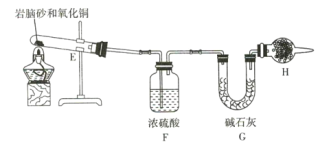
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。