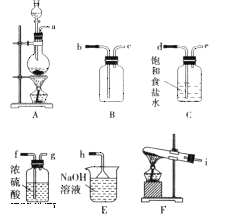
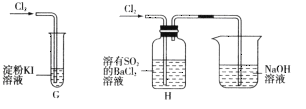
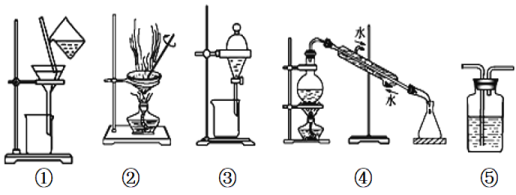
题目内容
【题目】二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点80℃,沸点135.6℃,对干二氯化二硫叙述正确的是
A.二氯化二硫的电子式为![]()
B.分子中既有极性键又有非极性键
C.二氯化二硫属于非极性分子
D.分子中S-Cl键能小于S-S键的键能
【答案】B
【解析】
A.S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,结合分子结构可知S2Cl2的结构式为Cl-S-S-Cl,电子式为![]() ,故A错误;
,故A错误;
B.S2Cl2中Cl-S属于极性键,S-S键属于非极性键,不对称的结构,为极性分子,故B正确;
C.分子的结构不对称,为极性分子,而不是非极性分子,故C错误;
D.同周期从左往右原子半径逐渐减小,所以氯原子半径小于硫原子半径,键长越短键能越大,所以分子中S-Cl键能大于S-S键的键能,故D错误;
故选B。

【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%