题目内容
【题目】已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
物质(mol) 时间 | NO | CO | N2 | CO2 |
起始 | 0.40 | 1.0 | ||
2 min 末 | 2.0 | 0.80 | 1.6 | |
4 min 末 | 1.6 |
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=________。
②试计算该温度下反应Ⅳ 的化学平衡常数 K=_________。
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。
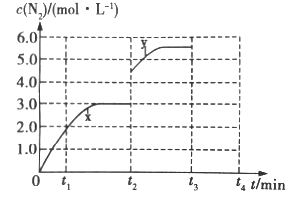
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是______。
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线______。
【答案】-746.5 kJ·mol-1低温0.10 mol·Lˉ1·minˉ11.6快速将容器体积由3L压缩到2L【答题空6】起点、拐点时间及趋势正确均给分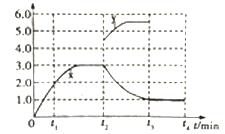
【解析】
已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)根据盖斯定律可知反应Ⅳ由(反应Ⅰ×2-反应Ⅱ-反应Ⅲ)得到,则△H=(-393.5 kJ·mol-1)×2-(-221 kJ·mol-1)-(+180.5 kJ·mol-1)= -746.5 kJ·mol-1;由△G=△H-T△S<0,其中△H<0、△S<0,可知该反应在低温下能自发进行;
(2)①求 0~2min 内N2的变化物质量为:1.0 mol-0.80 mol=0.2mol,则CO的变化物质的量为0.4mol,用 CO 来表示的平均反应速率 v(CO)=0.4mol÷2 L÷2 min=0.10 mol·Lˉ1·minˉ1 ;
②2min~4min 时CO2的物质的量没有发生变化,可知2min时反应达到平衡,此时: 2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)
N2(g) + 2CO2(g)
起始物质的量(mol) 0.4 1.0 0
变化物质的量(mol) 0.4 0.4 0.2
平衡物质的量(mol) 0.8 2.0 0.8 1.6
平衡浓度为(mol/L) 0.4 1.0 0.4 0.8
该温度下反应Ⅳ 的化学平衡常数 K=(0.4×0.82)÷(0.42×1.02)=1.6;
(3)①由图示可知c(N2)的浓度瞬间增大为原来的1.5倍,可通过快速将容器体积由3L压缩到2L即可;
②t2min时升高温度平衡逆向移动,c(N2)的浓度会减小,重新形成新的平衡状态,所得曲线如图所示: 。
。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案