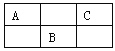
题目内容
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
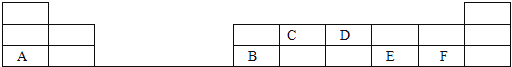
(1)画出D的原子结构示意图____________;
(2)写出C的最高价氧化物的电子式____________;
(3)E和F分别形成的气态氢化物中最稳定的是____________(填写氢化物的化学式);
(4)A的最高价氧化物的水化物的化学式是____________。
【答案】(1)![]() (2)
(2)![]() (3)HCl (4)NaOH
(3)HCl (4)NaOH
【解析】试题分析:根据元素在周期表中的相对位置可知A~F分别是Na、Al、C、N、S、Cl,则
(1)D是N,原子结构示意图为![]() ;
;
(2)碳元素的最高价氧化物是CO2,其电子式为![]() ;
;
(3)非金属性越强,氢化物越稳定,氯元素的非金属性强于硫,则氯化氢的稳定性强于硫化氢;
(4)钠的最高价氧化物的水化物是氢氧化钠,化学式为NaOH。

【题目】已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
物质(mol) 时间 | NO | CO | N2 | CO2 |
起始 | 0.40 | 1.0 | ||
2 min 末 | 2.0 | 0.80 | 1.6 | |
4 min 末 | 1.6 |
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=________。
②试计算该温度下反应Ⅳ 的化学平衡常数 K=_________。
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。
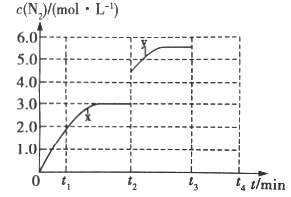
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是______。
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线______。