题目内容
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺.
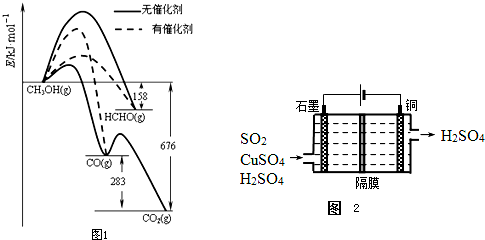
(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2n) H2O═2n CuSO4+(2-2n) H2SO4从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g.
②利用如图2所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式 .

(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
①在有催化剂作用下,CH3OH与O2反应主要生成
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H=
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2n) H2O═2n CuSO4+(2-2n) H2SO4从环境保护的角度看,催化脱硫的意义为
②利用如图2所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式
考点:有关反应热的计算,化学方程式的有关计算,化学电源新型电池,二氧化硫的化学性质
专题:化学反应中的能量变化,电化学专题,元素及其化合物
分析:(1)①使用催化剂可以降低反应的活化能,活化能越低,普通分子越容易转化成活化分子,反应越容易,反应速率越快;
②根据图表可知2HCHO(g)+O2(g)═2CO(g)+2H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答;
(2)①二氧化硫是一种有毒的气体,排放到空气中可引起酸雨的发生,对环境和人类健康有害,脱硫可以防止酸雨的发生;依据二氧化硫和氧气反应方程式,找出二氧化硫和氧气量的关系;
②利用电解原理将二氧化硫转化成硫酸吸收,先写出两个电极上上发生的电极反应式,加和就可得到总的离子方程式.
②根据图表可知2HCHO(g)+O2(g)═2CO(g)+2H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答;
(2)①二氧化硫是一种有毒的气体,排放到空气中可引起酸雨的发生,对环境和人类健康有害,脱硫可以防止酸雨的发生;依据二氧化硫和氧气反应方程式,找出二氧化硫和氧气量的关系;
②利用电解原理将二氧化硫转化成硫酸吸收,先写出两个电极上上发生的电极反应式,加和就可得到总的离子方程式.
解答:
解:(1)①根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO;
故答案为:HCHO;
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)KJ?mol-1=-470KJ?mol-1;
故答案为:-470KJ?mol-1;
(2)①脱硫可以减少二氧化硫的排放量,防止酸雨的发生;
故答案为:防止酸雨的发生;
2SO2 +O2 =2SO3
44.8L 32g
11.2L m
解得m=8g,
故答案为:8;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应式得:SO2+2H2O+Cu2+
4H++SO42-+Cu,
故答案为:SO2+2H2O+Cu2+
4H++SO42-+Cu.
故答案为:HCHO;
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)KJ?mol-1=-470KJ?mol-1;
故答案为:-470KJ?mol-1;
(2)①脱硫可以减少二氧化硫的排放量,防止酸雨的发生;
故答案为:防止酸雨的发生;
2SO2 +O2 =2SO3
44.8L 32g
11.2L m
解得m=8g,
故答案为:8;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应式得:SO2+2H2O+Cu2+
| ||
故答案为:SO2+2H2O+Cu2+
| ||
点评:本题考查了反应热的求算,盖斯定律,二氧化硫的污染和治理,电解原理,题目综合性强,难度较小,根据已经掌握的知识可以求解.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,NA个己烷分子所占的体积约为22.4L |
| B、常温常压下,4g氦气含NA个原子 |
| C、1mol NaHCO3晶体中含有NA个CO32- |
| D、1mol Na2O2与足量的CO2气体充分反应后,转移的电子总数为2NA个 |
将0.48g Mg粉加入到500mL 0.1mol/L的硝酸中恰好完全反应,则还原产物可能是( )
| A、NO2 |
| B、NO |
| C、N2O3 |
| D、NH4+ |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、T℃时,1L pH=6纯水中,含10-8NA个OH- | ||
B、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
| ||
| C、15.6g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| D、1mol SiO2中含有2mol Si-O单键 |
下列实验操作错误的是( )
| A、要分离氯化钾、二氧化锰的混合物可通过溶解、过滤、蒸发等操作来完成 |
| B、检验某溶液中是否含SO42-时,应向该溶液中依次加入BaCl2溶液和稀盐酸 |
| C、向含FeSO4杂质的MgSO4溶液中依次加入过氧化氢、碳酸镁,充分搅拌后过滤,可除去FeSO4杂质,得到较纯净的MgSO4溶液 |
| D、测定硫酸铜晶体中结晶水含量时,要灼烧至固体完全变白 |