题目内容
(Ⅰ)有A、B、C、D 四种化合物,分别由K+、Ba2+、SO42-、CO32-、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈强碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊.
(1)推断A、B、C、D的化学式.
A ;B ;C ;D ;
(2)写出下列反应的离子方程式.
B与盐酸反应 .
C与硫酸反应 .
E与足量澄清石灰水反应 .
(Ⅱ)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子.
A组: .
B组: .
(1)推断A、B、C、D的化学式.
A
(2)写出下列反应的离子方程式.
B与盐酸反应
C与硫酸反应
E与足量澄清石灰水反应
(Ⅱ)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子.
A组:
B组:
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:(I)K+、Ba2+、SO42-、CO32-、OH-可能组成的化合硫酸钾、硫酸钡、碳酸钾、碳酸钡、氢氧化钾、氢氧化钡.
不溶于水化合物:硫酸钡、碳酸钡;
不溶于水但是溶于盐酸并且放出无色气味的E:碳酸钡;
能够与硫酸、盐酸放出无色无味气体的化合物可能是:碳酸钡、碳酸钾;
水溶也呈碱性的:氢氧化钾、氢氧化钡、碳酸钾;
E可使澄清石灰水变浑浊:E是二氧化碳,以此推断各物质;
(Ⅱ)A组和B组没有明确的要求,只要从离子能否大量共存的角度将离子分成两组即可.
不溶于水化合物:硫酸钡、碳酸钡;
不溶于水但是溶于盐酸并且放出无色气味的E:碳酸钡;
能够与硫酸、盐酸放出无色无味气体的化合物可能是:碳酸钡、碳酸钾;
水溶也呈碱性的:氢氧化钾、氢氧化钡、碳酸钾;
E可使澄清石灰水变浑浊:E是二氧化碳,以此推断各物质;
(Ⅱ)A组和B组没有明确的要求,只要从离子能否大量共存的角度将离子分成两组即可.
解答:
解:(1)K+、Ba2+、SO42-、CO32-、OH-可能组成的物质有硫酸钾、硫酸钡、碳酸钾、碳酸钡、氢氧化钾、氢氧化钡.根据题意的无色无味的气体E为CO2.
只有BaSO4 不溶于水和盐酸,故A为BaSO4;
BaCO3不溶于水但是溶于盐酸并放出无刺激性气味的气二氧化碳说明B是BaCO3,故B为BaCO3;
水溶液呈碱性的有:氢氧化钾、氢氧化钡、碳酸钾,因为C呈碱性且与硫酸反应生成A BaSO4,说明C中含有Ba2+,故C为Ba(OH)2;
D可溶于水,排除硫酸钡、碳酸钡,与硫酸作用时放出气体二氧化碳,说明含有CO32-,故D为K2CO3.
故答案为:BaSO4; BaCO3;Ba(OH)2;K2C03;
(2)碳酸钡和盐酸反应:BaCO3+2HCl=BaCl2+CO2↑+H2O,离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
氢氧化钡和硫酸反应:Ba(OH)2+Na2SO4 =BaSO4+2NaOH,离子方程式为Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓,
二氧化碳和足量澄清石灰水反应:Ca(OH)2+CO2=CaCO3↓+H2O,离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓;CO2+Ca2++2OH-=CaCO3↓+H2O;
(Ⅱ)设A组中含有Cu2+,Cu2+与CO32-、OH-分别反应生成沉淀而不能共存,CO32-、OH-则应存在于B组中,CO32-、OH-与H+反应而不能共存,则H+应存在于A组,
又每组中均含两种阳离子和两种阴离子,
所以A组中应还含有NO3-、Cl-,B组中还应含有Na+、K+,
所以A组中含有Cu2+、H+、Cl-、NO3-,B组中含有Na+、K+、OH-、CO32- ( A、B可对换),
故答案为:Cu2+、H+、Cl-、NO3-;Na+、K+、OH-、CO32- ( A、B可对换).
只有BaSO4 不溶于水和盐酸,故A为BaSO4;
BaCO3不溶于水但是溶于盐酸并放出无刺激性气味的气二氧化碳说明B是BaCO3,故B为BaCO3;
水溶液呈碱性的有:氢氧化钾、氢氧化钡、碳酸钾,因为C呈碱性且与硫酸反应生成A BaSO4,说明C中含有Ba2+,故C为Ba(OH)2;
D可溶于水,排除硫酸钡、碳酸钡,与硫酸作用时放出气体二氧化碳,说明含有CO32-,故D为K2CO3.
故答案为:BaSO4; BaCO3;Ba(OH)2;K2C03;
(2)碳酸钡和盐酸反应:BaCO3+2HCl=BaCl2+CO2↑+H2O,离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
氢氧化钡和硫酸反应:Ba(OH)2+Na2SO4 =BaSO4+2NaOH,离子方程式为Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓,
二氧化碳和足量澄清石灰水反应:Ca(OH)2+CO2=CaCO3↓+H2O,离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓;CO2+Ca2++2OH-=CaCO3↓+H2O;
(Ⅱ)设A组中含有Cu2+,Cu2+与CO32-、OH-分别反应生成沉淀而不能共存,CO32-、OH-则应存在于B组中,CO32-、OH-与H+反应而不能共存,则H+应存在于A组,
又每组中均含两种阳离子和两种阴离子,
所以A组中应还含有NO3-、Cl-,B组中还应含有Na+、K+,
所以A组中含有Cu2+、H+、Cl-、NO3-,B组中含有Na+、K+、OH-、CO32- ( A、B可对换),
故答案为:Cu2+、H+、Cl-、NO3-;Na+、K+、OH-、CO32- ( A、B可对换).
点评:本题考查物质的检验和鉴别的实验方案的设计,为高频考点,把握离子的性质及发生的反应为解答的关键,注意离子的共存及常见离子之间的反应,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
由于易被空气中的氧气氧化而不能长期存放在敞口容器中的是( )
| A、浓盐酸 |
| B、硫酸亚铁(FeSO4)溶液 |
| C、NaOH溶液 |
| D、过氧化纳(Na2O2) |
化学世界是个五彩缤纷的世界,下列关于颜色的变化叙述正确的是( )
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |
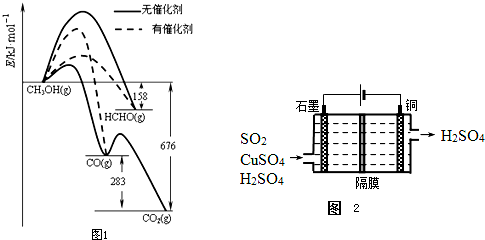
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物. I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是 (Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断:
(Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断: