题目内容
15.下列说法中,正确的是( )| A. | 由不同元素组成的共价化合物中一定只存在极性键 | |
| B. | 多电子原子中,在离核较远的区域内运动的电子能量较低 | |
| C. | 科学家在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 决定化学反应是吸收能量还是放出能量的是反应物总能量的多少 |
分析 A、共价化合物可能存在极性键、非极性键或都存在;
B、离核较近的区域能量较低,能量高的电子在离核较远的区域内运动;
C、在过渡元素中寻找制造催化剂元素及制造高温、耐腐蚀合金材料;
D、化学反应中的能量变化通常表现为热量的变化,能量变化的原因与反应条件无关,由化学键的断裂和形成决定的,与反应物和生成物总能量的相对大小有关.
解答 解:A、不同元素组成的共价化合物分子中也可能含有非极性键,如H2O2,故A错误;
B、离核较近的区域能量较低,多电子原子中,能量高的电子在离核较远的区域内运动,故B错误;
C、优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素,故C正确;
D、化学反应中的能量变化通常表现为热量的变化,由化学键的断裂和形成决定的,与反应物和生成物总能量的相对大小有关,故D错误,
故选C.
点评 本题主要考查的是化学键、元素周期律的应用以及化学反应中能量变化的判断,本题的难度不大,属于常考题.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
3.物质的量单位是( )
| A. | mol | B. | g/mol | C. | g | D. | mol/L |
20.关于下列各实验装置图的叙述中,正确的是( )

| A. | 装置①可用于分离碘和氯化钠的固体混合物 | |
| B. | 装置②可用于吸收HCl或NH3气体 | |
| C. | 装置③可用于分解NH4HCO3制备NH3 | |
| D. | 装置④b口进气可收集CO2或NO气体 |
7.以碳化硅、氮化镓(GaN)等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料.
(1)上述各种元素中,原子半径最小的元素原子的结构示意图是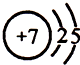 .
.
(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
①氢氧化镓的电离方程式是Ga3++3OH-?Ga(OH)3?GaO2-+H++H2O.
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
(1)上述各种元素中,原子半径最小的元素原子的结构示意图是
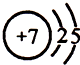 .
.(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
4.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将铁片放入浓硫酸中 | 无明显变化 | 铁与浓硫酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | 乙醇中的氢原子均能与Na反应 |
| D | 氯气通入品红溶液中 | 品红褪色 | 氯分子有漂白作用 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol ${\;}_{8}^{16}$OD-离子含有的质子、中子数均为10NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| D. | VL a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目等于3NA |