题目内容
18.辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如图1所示:(1)Cu2S中Cu元素的化合价是+1价.
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的正极(填“正”或“负”)相连.
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是Cu2+的氧化性大于Fe2+的氧化性.
③电解一段时间后,溶液中Cu2+浓度减小.(填“减小”、“增大”、“不变”)
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经如图2所示方法脱除SO2,并制得H2SO4.
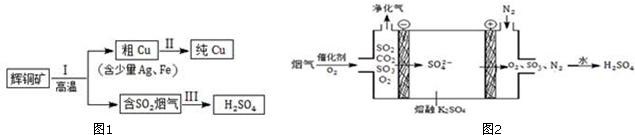
①在阴极放电的物质是O2.
②在阳极生成SO3的电极反应式是2SO42--4e-=2SO3↑+O2.
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水.
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液.
iii.过滤、洗涤、干燥,称量沉淀质量.
①用离子方程式表示i中溴水的主要作用SO32-+Br2+H2O=SO42-+2Br-+2H+.
②若沉淀的质量越大,说明SO2的脱除率越低(填“高”或“低”).
(5)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.H3PO2是一元中强酸,写出其电离方程式H3PO2?H2PO2-+H+.
③NaH2PO2为正盐(填“正盐”或“酸式盐”)其溶液显弱碱性(填“弱酸性”、“中性”或“弱碱性”).
分析 (1)化合物中S元素常见负化合价为-2价;
(2)根据电解原理分析电解精炼铜的阳极材料;依据溶液中阳离子的放电顺序回答;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,据此解答即可;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,据此解答即可;
(5)H3PO2是一元中强酸,部分电离生成氢离子和H2PO2-,NaH2PO2为正盐,水解呈碱性.
解答 解:(1)化合物中S元素常见负化合价为-2价,故Cu的化合价为+1,故答案为:+1;
(2)①电解法炼铜时,阳极发生氧化反应、阴极发生还原反应,所以阳极为粗铜板,粗铜板中的金、银还原性比铜的弱,反应后以单质的形式在电解槽阳极的槽底,在电解槽的阴极铜离子得到电子生成金属铜,该电极反应为:Cu2++2e-═Cu,故答案为:正;
②由于Cu2+的氧化性大于Fe2+的氧化性,故溶液中的铜离子放电析出,故答案为:Cu2+的氧化性大于Fe2+的氧化性;
③阳极为铜,含有铁,铁先被氧化,而阴极只有铜析出,则铜离子浓度减小,故答案为:减小;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,发生反应的离子反应方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,故答案为:低;
(5)H3PO2是一元中强酸,部分电离生成氢离子和H2PO2-,电离方程式为H3PO2?H2PO2-+H+,NaH2PO2为正盐,水解呈碱性,
故答案为:H3PO2?H2PO2-+H+;正盐;弱碱性.
点评 本题考查了物质分离提纯的方法和流程分析应用,主要涉及物质性质的理解,为高频考点,侧重于学生的分析能力的考查,本题涉及电解知识,注意把握电解原理,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案a.取25mL NaOH溶液,向其中通入过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸此溶液1~2min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式:NaOH+CO2═NaHCO3、NaHCO3+NaOH═Na2CO3+H2O.
(2)煮沸溶液的目的是充分将溶液中的二氧化碳赶出.此方案第一步的实验装置如图所示:

(3)加入反应物前,如何检查整个装置的气密性用弹簧夹夹住A、B连接处,先检查A的气性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气.然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气(也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住.然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气).
(4)装置B中盛放的试剂是饱和NaHCO3溶液,作用是吸收HCl气体.
(5)在实验室制法中,装置A还可作为下列②④⑤气体的发生装置(填序号).
①CH2=CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(6)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理并能用图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
| 尾 气 吸 收 装 置 |  |  |
| 处理气体 | ①③ | ②④ |
 研究硫及其化合物的性质有重要意义.
研究硫及其化合物的性质有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g),SO2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”);
②平衡常数:A点=B点(填“>”、“=”或“<”);
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,v(O2)=0.08mol•L-1•min-1;
(2)一定温度下,用水吸收SO2气体,若得到pH=3的H2SO3溶液,试计算溶液中c(HSO3-)/c(SO32-)
=$\frac{1}{6}$.(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol/LCH3COONa溶液中含有1 mol/LCH3COO- | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| A. | mol | B. | g/mol | C. | g | D. | mol/L |
(1)上述各种元素中,原子半径最小的元素原子的结构示意图是
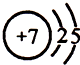 .
.(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
| A. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| B. | 纯锌与稀硫酸反应产生氢气速率较慢;再加入少量CuSO4 固体,速率不改变 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉可以溶解 | |
| D. | 向AlCl3 溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4 溶液,沉淀消失 |