题目内容
10.溶液中的化学反应大多是离子反应.根据要求回答下列问题.(1)盐碱地(含较多Na2C03、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因Na2CO3+H2O?NaOH+NaHCO3;农业上用石膏降低其碱性的反应原理Na2CO3+CaSO4=Na2SO4+CaCO3↓.
(2)已知水存在如下平衡:H2O+H2O?H2O++OH-,向水中加入NaHSO4固体,水的电离平衡向逆反应方向移动,且所得溶液显酸性.
(3)若取pH、体积均相等的NaOH和氨水分别加水稀释m倍、n倍稀释后pH仍相等,则m<n(填“>”“<”或“=”);
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=10-8 mol/L;
(5)常温下,CaCO3的溶度积Ksp=2.8×10-9,已知CaCl2的浓度为0.01mol•L-1,当它与Na2CO3溶液等体积混合后刚好完全反应,则Na2CO3溶液的浓度为1.12×10-6mol/L.
分析 (1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;石膏的成分是硫酸钙,硫酸钙和碳酸钠反应生成难溶性的碳酸钙,同时生成强酸强碱盐;
(2)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离;
(3)一水合氨是弱电解质,加水稀释促进一水合氨电离;
(4)常温下,pH=6的混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,则混合溶液中水电离出来的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;
(5)Ksp=c(Ca 2+).c(CO32-),两种溶液等体积混合后,其浓度都降为原来的一半,设原来Na2CO3溶液的浓度为xmol/L,则二者等体积混合后碳酸钠溶液浓度为0.5xmol/L、氯化钙溶液浓度为0.005mol/L,利用溶度积常数计算原来碳酸钠溶液浓度.
解答 解:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,化学方程式为水解方程式为Na2CO3+H2O?NaOH+NaHCO3;石膏是主要成分是CaSO4,Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,硫酸根离子和钠离子不水解,则其溶液呈中性,所以石膏能降低其碱性,反应方程式为Na2CO3+CaSO4=Na2SO4+CaCO3↓,
故答案为:Na2CO3+H2O?NaOH+NaHCO3;Na2CO3+CaSO4=Na2SO4+CaCO3↓;
(2)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离,水的电离平衡逆向移动,
故答案为:逆反应方向;酸;
(3)一水合氨是弱电解质,加水稀释促进一水合氨电离,NaOH是强电解质,完全电离,要使pH相等的氨水和NaOH溶液稀释后pH仍然相等,则氨水稀释倍数大于NaOH,即m<n,故答案为:<;
(4)常温下,pH=6的混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,则混合溶液中水电离出来的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8 mol/L,
故答案为:10-8 mol/L;
(5)Ksp=c(Ca 2+).c(CO32-),两种溶液等体积混合后,其浓度都降为原来的一半,设原来Na2CO3溶液的浓度为xmol/L,则二者等体积混合后碳酸钠溶液浓度为0.5x mol/L、氯化钙溶液浓度为0.005mol/L,所以0.5x×0.005=2.8×10-9,x=1.12×10-6,故答案为:1.12×10-6 mol/L.
点评 本题考查较综合,涉及难溶物的溶解平衡、弱电解质的电离、盐类水解等知识点,明确弱电解质电离特点、难溶物溶度积常数含义、盐类水解原理等即可解答,易错点是(5)题,注意二者等体积混合时各物质浓度会降为原来一半,题目难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
| A. | 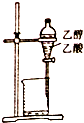 除去乙醇中的乙酸 | B. |  形成原电池 | ||
| C. | 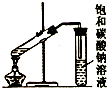 制取乙酸乙酯 | D. | 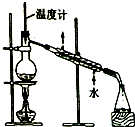 石油的蒸馏 |
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 全部由非金属元素形成的化合物不一定只含共价键 | |
| C. | 离子化合物中不可能含有非极性键 | |
| D. | 非极性键只存在于双原子单质分子中 |
| A. | NaCl | B. | NaOH | C. | H2 | D. | HCl |
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下: