题目内容
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。 (2)由A、B两种元素以原子个数比5∶1形成离子化合物X,X的电子式为 。
(3)由A、B元素形成的化合物B2A4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为 。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。②若E是非金属元素,其单质在电子工业中有重要应用,其氧化物晶体中E原子的杂化方式为 。 (5)由A、C、D、F四种元素形成的化合物Y(DAFC3)(已知A2FC3的Ka1=1.3×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为 ;向Y溶液中加入一定量的NaOH,使溶液中c(AFC3-)=c(FC32-),则此时溶液呈 (填“酸性”、“碱性”或“中性”);用惰性电极电解Y的水溶液,阳极无气体产生,阳极的电极反应式为 。
(15分)(1)S2->O2->Na+(2分,用<符号连接且正确同样给分,用字母表示不给分)
(2)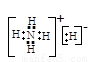 (2分,H-的两个电子分开写不给分)(3)N2H4
—4e— + 4OH—=N2
+ 4H2O(2分)
(4)2Al+Fe2O3
(2分,H-的两个电子分开写不给分)(3)N2H4
—4e— + 4OH—=N2
+ 4H2O(2分)
(4)2Al+Fe2O3 Al2O3+2Fe(2分, 不写条件扣1分) sp3(1分)
Al2O3+2Fe(2分, 不写条件扣1分) sp3(1分)
(5)c(Na+)>c(HSO3-)> c(H+) >c(SO32-)>c(OH-)(2分); 碱性(2分);
HSO3-—2e— + H2O = SO42-+ 3H+(2分)
【解析】
试题分析:C元素的原子最外层电子数是次外层电子数的三倍,则C一定是第二周期元素,因此C是氧元素;C与F同主族,都是短周期元素,则F是硫元素;D与E和F同周期,且D是所在周期原子半径最大的主族元素,所以D是钠元素。A与D同主族,B与C同周期,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,由于E的原子序数小于F的,因此E元素形成的单质一定不是气态,则A和B元素形成的单质就一定是气态,所以A是氢元素,B是氮元素,E是Mg或Al或Si或P中的其中一种。
(1)离子的核外电子层数越多,离子半径越大。则硫离子半径大于氧离子半径。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以杨离子半径大于钠离子半径,因此C、D、F三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+。
(2)由H、N两种元素以原子个数比5∶1形成离子化合物X,则X应该是由NH4+和H-形成的离子化合物,所以X的电子式为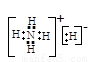 。
。
(3)由A、B元素形成的化合物B2A4是N2H4,该化合物可以与O2、KOH溶液形成原电池。由于原电池中负极失去电子,正极得到电子,因此氧气在正极通入,N2H4在负极失去电子,所以该原电池负极的电极反应式为N2H4 —4e— + 4OH—=N2 + 4H2O。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,该反应是铝热反应,因此E是Al,则反应的化学方程式为2Al+Fe2O3 Al2O3+2Fe。
Al2O3+2Fe。
②若E是非金属元素,其单质在电子工业中有重要应用,则E是Si。其氧化物是二氧化硅。在二氧化硅晶体中硅原子全部以单键与氧元素形成共价键,因此硅原子的杂化方式为sp3杂化。
(5)由A、C、D、F四种元素形成的化合物Y(DAFC3),则Y是亚硫酸氢钠。已知H2SO3的Ka1=1.3×10-2、Ka2=6.3×10-8,因此在亚硫酸氢钠溶液中HSO3-的电离程度大于HSO3-的水解程度,所以溶液显酸性,因此Y溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3-)> c(H+) >c(SO32-)>c(OH-); 向Y溶液中加入一定量的NaOH,使溶液中c(HSO3-)=c(SO32-),则根据电荷守恒可知c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),所以c(H+)+c(Na+)=3c(HSO3-)+c(OH-)。根据物料守恒可知c(Na+)>3c(HSO3-),所以c(H+)<c(OH-),因此溶液碱性;电解池中阳极失去电子,用惰性电极电解亚硫酸氢钠的水溶液,阳极无气体产生,这说明溶液中的OH-没有放电。由于亚硫酸氢钠具有还原性,易被氧化,因此放电的离子应该是HSO3-,则阳极的电极反应式为HSO3-—2e— + H2O = SO42-+ 3H+。
考点:考查元素位置、结构和性质的应用与判断;铝热反应、电极反应式、电子式的书写以及杂化轨道类型的判断;溶液中离子浓度大小比较和溶液酸碱性的判断

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.