��Ŀ����
������һ����ࡢ��Ч��������Դ��
I.�ü�����ȡ�����ķ�Ӧ��Ϊ�������������仯����ͼ��ʾ��
��1�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
II.���ݻ�Ϊ1L���ܱ������ڣ�����0.1molCO��0.1molH2O���ڴ������ڵ������¸��¼���ʹ�䷴Ӧ�����CO2��Ũ����ʱ��仯��ͼ����ͼ��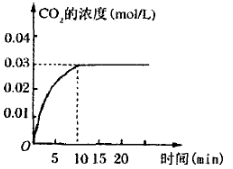
��2���ڸ��¶��£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO��ƽ����Ӧ����Ϊ ��
��3�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ�������÷�����ʾ�� ��
��4�����иı��У���ʹƽ��������Ӧ�����ƶ����� ��
| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
��ÿ��2�֣���10�֣�
��1��CH4(g) + 2H2O(g) �� 4H2(g) + CO2(g) ��H����136.5 kJ/mol
��2��0.003 mol��L-1��min-1 ��3��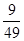 ��4��CD
��4��CD
��5��������Q= ,���Ը÷�Ӧ������Ӧ�������
,���Ը÷�Ӧ������Ӧ�������
���������������1������ͼ���֪�������ˮ����������������������CO2�������������Ը��ݸ�˹���ɿ�֪���÷�Ӧ�ķ�Ӧ���Ǧ�H��-103.3 kJ/mol��33.2 kJ/mol����136.5 kJ/mol��������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��CH4(g) + 2H2O(g) �� 4H2(g) + CO2(g) ��H����136.5 kJ/mol��
��2������ͼ���֪����Ӧ���е�10minʱ�õ�ƽ��״̬��ƽ��ʱ����CO2��Ũ����0.03mol/L��������CO��Ũ����0.03mol/L������CO�ķ�Ӧ������0.03mol/L��10s��0.003 mol��L-1��min-1��
��3��ƽ��ʱCO��ˮ������Ũ�Ⱦ���0.1mol/L��0.03mol/L��0.07mol/L����������CO2��������Ũ�Ⱦ���0.03mol/L�����Ը��¶��·�Ӧ��ƽ�ⳣ��K�� ��
��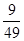 ��
��
��4��A������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���A����ȷ��B����Ӧǰ��������䣬��������ƽ�ⲻ�ƶ���B����ȷ��C������ˮ������Ũ�ȣ�ƽ��������Ӧ�����ƶ���C��ȷ��D����СCO2��Ũ�ȣ�ƽ��������Ӧ�����ƶ���D��ȷ����ѡCD��
��5������ʼʱc(CO)��1mol��L-1 , c(H2O)��2 mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.4 mol��L-1����˵������CO��ˮ������Ũ�Ⱦ���0.4mol/L������ƽ��ʱCO��H ˮ������Ũ�ȷֱ���0.6mol/L��1.6mol/L����Q�� �����Ը÷�Ӧ������Ӧ������С�
�����Ը÷�Ӧ������Ӧ������С�
���㣺���鷴Ӧ�ȡ���Ӧ���ʡ�ƽ�ⳣ���ļ��㡢���������ƽ��״̬��Ӱ���Լ�ƽ�ⳣ����Ӧ��

��15�֣��������糧�ͷų������������NOx����SO2��CO2���������ɻ������⡣��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4(g) �� 4NO2(g) ��4NO(g) �� CO2(g) �� 2H2O(g) ��H1����574 kJ��mol��1
CH4(g) �� 4NO(g) ��2N2(g) �� CO2(g) �� 2H2O(g) ��H2����1160 kJ��mol��1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����̼����CO2ת��Ϊ�״���CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3

����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ1��ʾ���ش�0~10 min�ڣ�������ƽ����Ӧ����Ϊ mol/(L��min)����10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ƽ�� ������������������ƶ���
��ȡ��ݵ������CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H3 0�����������������������
��3����������Na2SO3��Һ���ѳ������е�SO2��Na2SO3����NaOH��Һ����SO2�Ƶá�NaOH��Һ����SO2�Ĺ����У�pH��n(SO32-)�Un(HSO3��)�仯��ϵ���±���
| n(SO32��)�Un(HSO3��) | 91�U9 | 1�U1 | 9�U91 |
| pH | 8.2 | 7.2 | 6.2 |
�� ����Һ������ʱ������Ũ�ȹ�ϵ��ȷ���ǣ�ѡ����ĸ��������������
a��c(Na+)=2c(SO32-)+c(HSO3-)
b��c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c��c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
��14�֣��������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ�� ��
��
��1��Ϊ�˼ӿ�����Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________������ţ���ͬ����
| A��ʹ�ô��� | B�����������Ũ�� |
| C����߷�Ӧ���¶� | D�����ͷ�Ӧ���¶� |
��3���Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����֪����ѧ���ļ��ܣ�
| ��ѧ�� | H��H | O��O | H��O |
����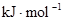 | 436 | 496 | 463 |
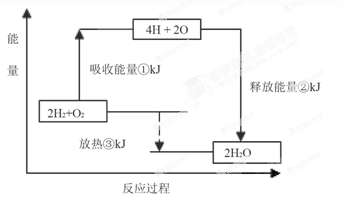
��4����֪1��������ȫȼ������Һ̬ˮ�ų�QKJ��������������ȼ������Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ
��5������ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ
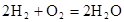 �����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��
�����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g) 
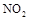 ��������
��������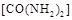 ��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��
��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��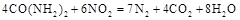 �������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
�������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��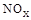 ��,�������з�������Ҫ��Ӧ�У�
��,�������з�������Ҫ��Ӧ�У�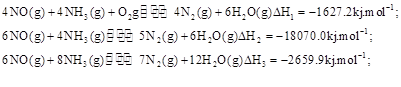
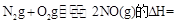 KJ/mol
KJ/mol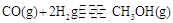 ����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
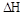 0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��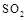 ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��
ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��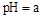 ����
����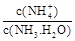 = ���ú�a�Ĵ���ʽ��ʾ����֪
= ���ú�a�Ĵ���ʽ��ʾ����֪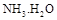 �ĵ��볣��
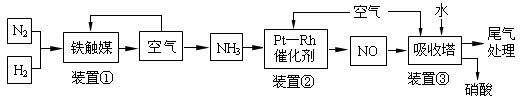
�ĵ��볣��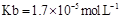 ����
����
 2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����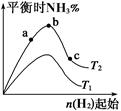
 2NO(g) ��H����180.5 kJ��mol-1
2NO(g) ��H����180.5 kJ��mol-1
 CH3OH(g) ��H1=��116 kJ��mol��1
CH3OH(g) ��H1=��116 kJ��mol��1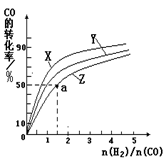

 O2(g)=CO2(g) ��H2=��283 kJ��mol��1
O2(g)=CO2(g) ��H2=��283 kJ��mol��1