题目内容
【题目】【实验化学】
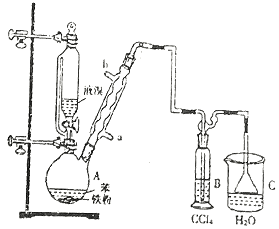
己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]()

可能用到的有关数据如下:

实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)仪器a的名称为_ _。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果: _。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O
如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为(写一个即可):
________ ____。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
【答案】
(1)恒压滴液漏斗(2分)
(2)反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的NO2气体来不及被碱液吸收而外逸到空气中 (答对其中1条即可给分,其它答案合理即给分,2分)
(3)2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2 (写对其中一个即可给满分,2分)
(4) 苯(2分)
(5)重结晶(2分); 75%(2分)
【解析】
试题分析:
(1)恒压滴液漏斗;
(2)反应中温度过高会使反应液暴沸冲出冷凝管或放热过多可能引起爆炸;反应速率过快,产生的NO2气体来不及被碱液吸收而外逸到空气中造成污染;
(3)根据氮氧化物与碱发生歧化反应或归中反应,与纯碱也应发生相似反应;
(4)产品不溶于苯,所以为了减少溶解损失可以用苯洗涤;
(5)提纯晶体一般可以采用重结晶法;
己二酸产率
n(环己醇)=5.4×0.962÷100=0.052mol
理论产量为:m(己二酸)=0.052×146=7.59g
产率为5.7÷7.59×100%=75%

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。

温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。