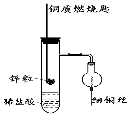
题目内容
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
①该电池的负极反应式是______________;
②在电池中,Na+不断移动到“水”电池的_______极(填“正”或“负”);
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是______________。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如右图所示。

①该电池工作时,b口通入的物质为______________。
②该电池负极的电极反应式______________。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_______________。
【答案】⑴①Ag—e—+Cl—=AgCl;②正;③2mol;
⑵①CH3OH;②CH3OH—6e—+H2O=CO2+6H+;③1.2⑶Ag2O2+2Zn+4KOH+2H2O==2K2Zn(OH)4+2Ag
【解析】
试题分析:(1)①根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,故答案为:Ag+Cl--e-=AgCl;
②在原电池中阴离子向负极移动,阳离子向正极移动,所以钠离子向正极移动,故答案为:正;
③根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,则外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是2mol,故答案为:2mol.
(2)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料甲醇,故答案为:CH3OH;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=![]() =1.2mol,则转移电子个数为1.2NA,故答案为:1.2;
=1.2mol,则转移电子个数为1.2NA,故答案为:1.2;
(3)电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,正极电极反应式为Ag2O2+4e-+2H2O═2Ag+4OH-,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,反应还应有KOH参加,反应的总方程式为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□____+□_____=□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g/mol,化学式是_______。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是__________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________(用代数式表示)