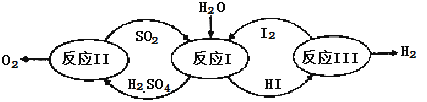
题目内容
【题目】某研究性学习小组同学对由某均匀混合的NaHCO3和KHCO3样品进行实验,测得实验如下图所示

已知:Ⅰ.所测气体体积为标准状况
Ⅱ.盐酸的物质的量浓度相等,且体积均是50mL;试计算:
(1)盐酸的物质的量浓度 mol·L-1。
(2)混合物样品中,NaHCO3与KHCO3的物质的量之比 。
【答案】(1)3mol/L (2)1:1
【解析】
试题分析:(1)根据图像可知产生的二氧化碳体积最大值是3.36L,物质的量是0.15mol,根据方程式H++HCO3-=H2O+CO2↑,所以盐酸的物质的量是0.15mol,其浓度是0.15mol÷0.05L=3.0mol/L。
(2)9.2g样品完全反应后产生2.24L二氧化碳,物质的量是0.1mol,设样品中碳酸氢钠和碳酸氢钾的物质的量分别是xmol、ymol,则x+y=0.1、84x+100y=9.2,解得x=y=0.05,即混合物样品中,NaHCO3与KHCO3的物质的量之比是1:1。

练习册系列答案
相关题目