题目内容
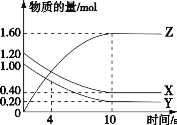
【题目】T℃时,在 2 L 的密闭容器中,气体 X、Y 和 Z 三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是
A. 容器中化学反应为 X(g)+Y(g)![]() Z(g)
Z(g)
B. 0~10 s,X 表示的平均化学反应速率为 0.04 mol/(L·s)
C. 使用催化剂只能加快 0~10 s 间的反应速率
D. 0~4 s 的平均反应速率小于 0~10 s 的平均反应速率
【答案】B
【解析】
A. 由图像可知反应在10s时达到化学平衡,此时X、Y分别减少了0.8mol、0.8mol,Z增加了1.6mol,所以反应的化学方程式为:X(g)+Y(g)![]() 2Z(g),故A错误;B. 0~10 s,X表示的平均化学反应速率为(0.8mol÷2L÷10s)=0.04 mol/(L·s),故B正确;C.使用催化剂不仅加快0~10s间的反应速度,平衡后的速率也加快,故C错误;D.随着反应进行反应物浓度减小,速率减小,所以0~4s的平均反应速率大于0~10s时平均反应速率,故D错误;答案选B。
2Z(g),故A错误;B. 0~10 s,X表示的平均化学反应速率为(0.8mol÷2L÷10s)=0.04 mol/(L·s),故B正确;C.使用催化剂不仅加快0~10s间的反应速度,平衡后的速率也加快,故C错误;D.随着反应进行反应物浓度减小,速率减小,所以0~4s的平均反应速率大于0~10s时平均反应速率,故D错误;答案选B。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目