题目内容
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol/L的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是( )
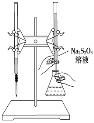
A. 该滴定反应可用甲基橙作指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定反应可选用如下图所示的装置
D. 该反应中每消耗2 mol Na2S2O3,转移电子的物质的量为4 mol
【答案】B
【解析】
本题考查酸碱中和滴定知识。根据反应原理I2+2Na2S2O3=2NaI+Na2S4O6选择指示剂为淀粉,根据化合价的变化判断氧化剂、还原剂和得失电子数;根据溶液酸碱性选择滴定管。Na2S2O3溶液是强碱弱酸盐,选择碱式滴定管。
A.因为该反应为I2+2Na2S2O3===2NaI+Na2S4O3,是碘单质转变成了碘离子,检验碘的试剂是淀粉溶液,所以滴定反应不应用甲基橙作指示剂,应该用淀粉溶液作指示剂,故A项错误;B.在该反应中,I2的化合价降低,得到电子,I2作氧化剂,Na2S2O3中的S的化合价升高,失去电子,Na2S2O3是该反应的还原剂,故B项正确;C.Na2S2O3是强碱弱酸盐,其溶液显碱性,应该使用碱式滴定管盛装,不能用酸式滴定管盛装,C项错误;D.根据方程式I2+2Na2S2O3===2NaI+Na2S4O3知该反应中每消耗2 mol Na2S2O3,转移2 mol电子,故D项错误。

练习册系列答案
相关题目