题目内容
【题目】A~H为中学化学中的常见物质,它们之间的转化关系如下图所示,其中“○”代表化合物,“□”代表单质。A为治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体。

请回答下列问题:
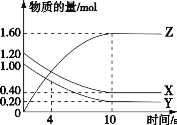
(1)G的化学式为_____________,反应③中,每生成1 mol H则转移________mol电子。
(2)反应①~④中,属于非氧化还原反应的是________(填序号)。
(3)写出下列反应的离子反应方程式:溶液A和H混合:_______________________________。向D的稀溶液中通入B: ______________________________________。
【答案】Na2O2 0.5 ①④ OH-+HCO3-=== CO32-+H2O CO32-+H2O+CO2=== 2HCO3-
【解析】
化合物G为淡黄色固体,化合物C在通常状况下为无色液体,二者反应生成气体单质E与化合物H,则G是Na2O2,C是H2O,H为NaOH,E是O2,由反应②可知单质F为Na.根据反应④可知D中含有Na元素,A是医疗上治疗胃酸过多的一种药剂,加热分解生成水、B及含Na元素化合物D,可推知A是NaHCO3,B为CO2,D为Na2CO3,二氧化碳与氢氧化钠反应生成碳酸钠与水,符合转化关系,
(1)由上述分析可知,G为Na2O2,反应③为2Na2O2+2H2O=4NaOH+O2↑,每生成1molNaOH需要0.5mol Na2O2,O元素化合价由-1价升高为0,故转移电子为0.5mol;
(2)再反应①②③④中,Na与氧气混合生成过氧化钠、过氧化钠与水反应生成氢氧化钠与氧气,二者都属于氧化还原反应,属于非氧化还原反应的是:①④;
(3)A是NaHCO3,H为NaOH,二者发生NaHCO3+NaOH=Na2CO3+H2O,离子反应方程式为OH-+HCO3-= CO32-+H2O;
D是Na2CO3,B为CO2,向D的稀溶液中通入B,离子反应方程式为CO32-+H2O+CO2= 2HCO3-。

 小学教材完全解读系列答案
小学教材完全解读系列答案