题目内容
能在水溶液中大量共存的一组离子是
| A.Na+、Mg2+、I-、ClO- | B.Al3+、NH4+、SO42-、Cl- |
| C.K+、Ag+、NO3-、Cl- | D.NH4+、Na+、OH-、SiO32- |
B
解析试题分析:镁离子与次氯酸根离子都能水解,相互促进对方的水解,可以发生双水解反应,生成氢氧化镁沉淀和次氯酸,碘离子与次氯酸根离子在酸性条件下容易发生氧化还原反应,生成单质碘、氯离子和水,即Mg2++2ClO-+2H2O=Mg(OH)2↓+2HClO、2I-+ClO-+2H+=I2+2Cl-+H2O,故A错误;Al3+、NH4+、SO42-、Cl-之间不能发生化学反应,故B正确;银离子与氯离子反应,生成氯化银沉淀,故C错误;铵根离子与硅酸根离子在水溶液中发生双水解反应,生成硅酸沉淀、氨气和水,铵根离子与氢氧根离子反应,生成一水合氨或氨气和水,故D错误。
考点:考查离子共存,涉及亚铁离子与硝酸的氧化还原反应、可溶性银盐与可溶性碳酸盐的复分解反应、铝盐溶液与偏铝酸盐溶液的双水解反应等。

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
下列表示对应化学反应的离子方程式正确的是
| A.足量Cl2通入FeBr2溶液中:Br-+ Cl2 = Br2 +2Cl- |
| B.用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO +CO(NH2)2=3Cl- +CO2↑+N2↑+2H2O |
| C.过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O = H2SiO3↓+CO32- |
| D.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ +HCO3-+OH-= CaCO3↓+H2O |
室温下,下列各组离子在指定溶液中一定能大量共存的是
| A.饱和氯水中:Cl-、NO3-、Na+、SO32- |
B.c(H+)=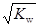 的溶液中:K+、Fe3+ 、Cl-、SO42- 的溶液中:K+、Fe3+ 、Cl-、SO42- |
| C.澄清透明的溶液中:Cu2+、NH4+、NO3-、ClO4- |
| D.使红色石蕊试纸变蓝的溶液中:CH3COO-、HCO3-、Na+、K+ |
在溶液中能大量共存的一组离子或分子是
| A.K+、Al3+、SO42―、NH3·H2O | B.NH4+、H+、NO3―、HCO3― |
C.Na+、CH3COO―、CO32―、OH― | D.Na+、K+、SO32―、Cl2 |
下列各组离子在溶液中能够大量共存的是
| A.NH4+、Ca2+、OHˉ、CO32ˉ |
| B.Ag+、H+、SO32ˉ、ClOˉ |
| C.NH4+、Brˉ、Na+、SO42ˉ |
| D.H+、Clˉ、Fe2+、NO3ˉ |
能在水溶液中大量共存的一组离子是
| A.H+、Fe3+、I-、SO42- |
| B.Al3+、Mg2+、HCO3-、Cl- |
| C.K+、Ca2+、NO3-、SiO32- |
| D.K+、Na+、OH-、AlO2- |
下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是( )
| A.K+、Na+、NO3-、SiO32- | B.Al3+、K+、SO42-、S2- |
| C.Ag+、Na+、NH3·H2O、NO3- | D.Cu2+、Fe2+、Cl-、SO42- |
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能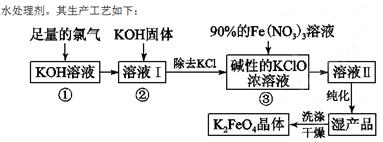
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。