题目内容
室温下,下列各组离子在指定溶液中一定能大量共存的是
| A.饱和氯水中:Cl-、NO3-、Na+、SO32- |
B.c(H+)=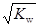 的溶液中:K+、Fe3+ 、Cl-、SO42- 的溶液中:K+、Fe3+ 、Cl-、SO42- |
| C.澄清透明的溶液中:Cu2+、NH4+、NO3-、ClO4- |
| D.使红色石蕊试纸变蓝的溶液中:CH3COO-、HCO3-、Na+、K+ |
C
解析试题分析:饱和氯水具有强氧化性,将SO32-氧化为SO42-,即Cl2+H2O+ SO32-=2H++2Cl-+ SO42-,故A错误;由于Kw= c(H+)·c(OH-),c(H+)=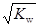 ,则c(H+)=
,则c(H+)=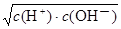 ,即c(H+)=c(OH-),该中性溶液中不能大量存在Fe3+,因为Fe3+能水解,使溶液呈弱酸性,故B错误;Cu2+、NH4+、NO3-、ClO4-之间不能反应,故C正确;碱性溶液能使红色石蕊试纸变蓝,HCO3-不能在碱性溶液中大量共存,因为HCO3-+ OH-=CO32-+H2O,故D错误。
,即c(H+)=c(OH-),该中性溶液中不能大量存在Fe3+,因为Fe3+能水解,使溶液呈弱酸性,故B错误;Cu2+、NH4+、NO3-、ClO4-之间不能反应,故C正确;碱性溶液能使红色石蕊试纸变蓝,HCO3-不能在碱性溶液中大量共存,因为HCO3-+ OH-=CO32-+H2O,故D错误。
考点:考查离子共存,需要分析各组离子的限制性条件。

练习册系列答案
相关题目
下列反应的离子方程式正确的是
A.NH4HCO3溶液与过量NaOH溶液共热:NH4++ OH一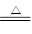 NH3↑+H2O NH3↑+H2O |
| B.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ |
| C.向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| D.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42一=BaSO4↓ +H2O |
在水溶液中能大量共存的一组是
| A.NH4+、Ag+、CO32-、SO42- | B.Fe2+、H+、MnO4-、HCO3- |
| C.K+、Na+、NO3-、SO42- | D.Al3+、Mg2+、C1-、SiO32- |
在水溶液中能大量共存的一组离子是
| A.NH4+、Na+、Br¯、SO42¯ | B.Fe2+、H+、ClO¯、Cl¯ |
| C.K+、Ca2+、OH¯、NO3¯ | D.Mg2+、H+、SiO32¯、SO42¯ |
常温下,下列各组离子在特定溶液中一定能大量共存的是
| A.pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- |
| B.c(Al3+) ="0.1" mol·L-1的溶液中:Na+、Cl-、HCO3-、SO42- |
| C.甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- |
| D.加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
能在水溶液中大量共存的一组离子是
| A.Na+、Mg2+、I-、ClO- | B.Al3+、NH4+、SO42-、Cl- |
| C.K+、Ag+、NO3-、Cl- | D.NH4+、Na+、OH-、SiO32- |
下列各组离子能大量共存的是
| A.NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B.加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C.无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D.pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
下列离子方程式的书写正确的是( )
| A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑ |
| B.NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O |
| C.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O |
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |