题目内容
9.下列各组物质在变化时,所克服的微粒间作用力属于同种类型的是( )| A. | 金刚石和晶体硫的熔融 | B. | 石墨和食盐的熔化 | ||
| C. | 晶体碘和晶体二氧化碳的升华 | D. | 冰的融化和硝酸钠的熔化 |
分析 A.金刚石属于原子晶体,金刚石中存在共价键;硫属于分子晶体,存在分子间作用力;
B.石墨属于混合晶体,存在分子间作用力和共价键;食盐属于离子晶体,存在离子键;
C.碘和二氧化碳都属于分子晶体,都存在分子间作用力和共价键;
D.冰属于分子晶体,存在共价键和分子间作用力;硝酸钠属于离子晶体,存在离子键.
解答 解:A.金刚石属于原子晶体,金刚石中存在共价键;硫属于分子晶体,存在分子间作用力,金刚石和硫熔融时分别破坏共价键和分子间作用力,故A错误;
B.石墨属于混合晶体,存在分子间作用力和共价键;食盐属于离子晶体,存在离子键,石墨和食盐熔融时分别破坏分子间作用力和共价键、离子键,故C错误;
C.碘和二氧化碳都属于分子晶体,都存在分子间作用力和共价键,碘和干冰升华时都只破坏分子间作用力,故C正确;
D.冰属于分子晶体,存在共价键和分子间作用力;硝酸钠属于离子晶体,存在离子键,冰融化破坏分子间作用力、硝酸钠熔融破坏离子键,故D错误;
故选C.
点评 本题考查化学键和分子间作用力,侧重考查分析判断能力,明确晶体类型是解本题关键,熟悉常见晶体类型,注意原子晶体熔融破坏共价键,易错选项是A.

练习册系列答案
相关题目
18.从废钒催化剂(主要成分为V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种工艺流程示意图如下,请回答下列问题:
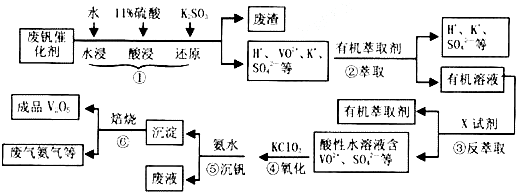
(1)步骤①中废渣的主要成分是SiO2,③中X试剂为H2SO4.
(2)②、③的变化过程可简化为R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂).为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移.
(3)请完成④中反应的离子方程式:
ClO3-+6VO2++6H+═6VO3++1Cl-+H2O.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产时⑤中加入氨水,调节溶液的最佳pH值为1.7~1.8.
(5)该工艺流程中,可以循环利用的物质有有机萃取剂、氨气.

(1)步骤①中废渣的主要成分是SiO2,③中X试剂为H2SO4.
(2)②、③的变化过程可简化为R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂).为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移.
(3)请完成④中反应的离子方程式:
ClO3-+6VO2++6H+═6VO3++1Cl-+H2O.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)该工艺流程中,可以循环利用的物质有有机萃取剂、氨气.
20.下列过程中,离子键被破坏的是( )
| A. | 溴挥发 | B. | 氯气被木炭吸附 | C. | 硫酸溶于水 | D. | 食盐溶于水 |
17.某元素最高价氧化物对应水化物的化学式为H2XO3,这种元素的气态氢化物的化学式是( )
| A. | HX | B. | XH4 | C. | XH3 | D. | H2X |
4.下列叙述中正确的是( )
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O${\;}_{2}^{2-}$与S2-具有相同的质子数和电子数 | |
| C. | 氕、氘、氚分别与O原子形成的水H2O、D2O、T2O的化性质不同 | |
| D. | 形成离子键的阴阳离子间只存在静电吸引力 |
14.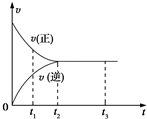 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
1.如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )


| A. | (3)(4)(2)(1) | B. | (3)(1)(4)(2) | C. | (4)(3)(1)(2) | D. | (3)(4)(1)(2) |
18.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
19.元素A、B、C原子序数之和为36,A、B在同一周期,A+与C2-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |