题目内容
12.有核电荷数依次增大的5种元素:A、B、C、D、E,符合如表所示的性质:| A | 最外层电子数是电子层数的2倍,单质为黑色固体 |
| B | 单质是空气的主要成分之一 |
| C | 与B不同主族,单质为淡黄色固体,易溶于二硫化碳 |
| D | 一种非金属元素 |
| E | 与D形成的某种化合物的水溶液遇苯酚溶液显紫色 |
(2)元素A和B中非金属性更强的元素是(填名称):氮,支持此结论的一种实验事实为硝酸的酸性比碳酸的酸性强
(3)元素C和D可以形成共价化合物C2D2,该化合物中各原子都达到8电子稳定结构,则该化合物的电子式为
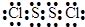
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,若生成的两种气体总体积为3360mL(已折算为标准状况)时,反应放出Q (Q>0)kJ的热量,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20QkJ•mol-1
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐:X和Y.同温下等浓度的X和Y的溶液中,pH更高的是(填名称)碳酸铵
(6)元素D和E形成的不与苯酚溶液显色的化合物为F,则检验F溶液中阳离子的方法为取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀,向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,则该反应过程中离子反应方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+(用一个总的离子方程式表示)
分析 A是最外层电子数是电子层数的2倍,单质为黑色固体,所以A是碳;C单质为淡黄色固体,易溶于二硫化碳是硫;B单质是空气的主要成分之一,与C不同主族,所以B是氮;E与D形成的某种化合物的水溶液遇苯酚溶液显紫色,说明D有强氧化性,与E铁生成三氯化铁,所以D是氯、E是铁,由此分析解答.
解答 解:(1)氮气的性质稳定用做保护气、制氨气,故答案为:保护气、制氨气;
(2)同周期从左到右非金属性增强,所以氮的非金属性强于碳,非金属性越强最高价氧化物对应的水化物的酸性越强,硝酸的酸性比碳酸的酸性强,故答案为:氮;硝酸的酸性比碳酸的酸性强;
(3)元素C和D分别是硫与氯,形成S2Cl2,电子式为: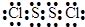 ,故答案为:
,故答案为: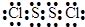 ;
;
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,分别是二氧化碳和二氧化硫,两者的物质的量之比为1:2,而生成0.15mol的混全气体放出热量为:Q,生成 3mol的混合气体放出热量为20Q,所以热方程式为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20 Q kJ•mol-1,故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20 Q kJ•mol-1;
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐碳酸铵和碳酸氢铵,碳酸根水解程度大于碳酸氢根,所以pH值大,故答案为:碳酸铵;
(6)元素D和E形成的不与苯酚溶液显色的化合物是氯化亚铁,亚铁离子的检验方法为:取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀;或滴加硫氰化钾溶液不变红,滴加氯水变红;向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,离子方程式为:6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+,故答案为:取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀;6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+.
点评 本题考查元素的位置与性质之间的关系,学生只要正确推出元素的种类,结合元素化合物的性质就可以迅速解题,综合性强有一定的难度.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 18g 18O2 中含有NA个氧原子 | |
| B. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |
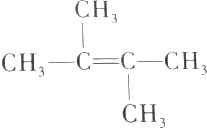 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )| A. | 该烯烃分子中的所有原子都在同一平面上 | |
| B. | 该烯烃分子中有4个碳原子可能在一条直线上 | |
| C. | 该烯烃分子中的6个碳原子不可能都在同一平面上 | |
| D. | 该烯烃与CH2=C(CH2CH3)2互为同分异构体 |
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| C. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液 加入过氧化钠以上各离子量几乎不减少 | |
| D. | 2H2O2(l)═2H2O(l)+O2(g);△H=-98.2 kJ/mol,△S=70.5 J/mol•K,该反应低温能自发进行 |
| A. | K+、Cu2+、OH-、NO3- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | NH4+、OH-、Cl-、HCO3- |
 .
. .
.