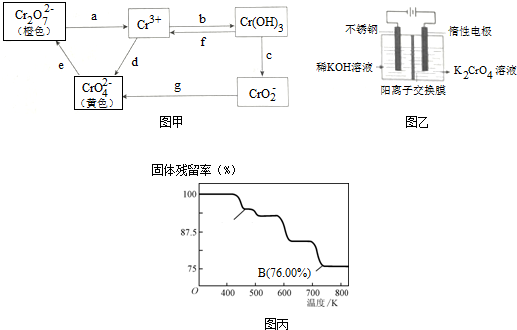
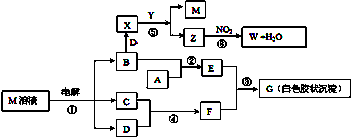
题目内容
7.丙烷高温裂解生成甲烷和乙烯两种物质.现取丙烷裂解混和物1L充分燃烧后生成相同状况下的二氧化碳为2.25L,则丙烷裂解的百分率是( )| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
分析 设丙烷体积为YL,其中有X L的丙烷分解,依据丙烷分解方程式,列出三段式,依据碳原子个数守恒及燃烧得到二氧化碳关系计算解答.
解答 解:设共有C3H8 Y L,其中有X L的C3H8分解,
C3H8→CH4 +C2H4
起始时 Y 0 0
转化量 X X X
终止时 Y-X X X
分解后气体共1L,即Y-X+X+X=1,X+Y=1,故Y=1-X
分解后气体1L中 有 Y-X=1-2X L的C3H8 X L的CH4 XL的C2H4
依据碳原子守恒可知:1-2X L的C3H8生成的CO2有 3(1-2X),
CH4生成的CO2有 XL,
C2H4生成的CO2有 2X L
所以:3-6X+2X+X=2.25
解得X=0.25,所以原来丙烷有1-2X+X=0.75L,分解的丙烷就是0.25升,
丙烷的分解率就是$\frac{0.25}{0.75}$×100%=33.3%;
故选B.
点评 本题考查了有关方程式的计算,明确丙烷分解的方程式结合碳原子个数守恒即可解答,题目难度不大.

练习册系列答案
相关题目
14.如图是一套实验室制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )


| A. | 浓H2SO4和NaCl晶体 | B. | 甲酸和浓H2SO4(制CO) | ||
| C. | MnO2和浓硫酸 | D. | 浓H3PO4和NaBr晶体 |
11.NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或二种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取二份等体积混合液,用盐酸的标准液(0.10mol/L)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1,则NaCl溶液中混有的杂质不可能为( )
| A. | NaOH | B. | Na2CO3 | C. | Na2CO3、NaHCO3 | D. | NaOH、Na2CO3 |
12.有核电荷数依次增大的5种元素:A、B、C、D、E,符合如表所示的性质:
(1)元素B的单质的用途是(任写一种):保护气、制氨气
(2)元素A和B中非金属性更强的元素是(填名称):氮,支持此结论的一种实验事实为硝酸的酸性比碳酸的酸性强
(3)元素C和D可以形成共价化合物C2D2,该化合物中各原子都达到8电子稳定结构,则该化合物的电子式为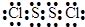
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,若生成的两种气体总体积为3360mL(已折算为标准状况)时,反应放出Q (Q>0)kJ的热量,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20QkJ•mol-1
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐:X和Y.同温下等浓度的X和Y的溶液中,pH更高的是(填名称)碳酸铵
(6)元素D和E形成的不与苯酚溶液显色的化合物为F,则检验F溶液中阳离子的方法为取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀,向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,则该反应过程中离子反应方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+(用一个总的离子方程式表示)
| A | 最外层电子数是电子层数的2倍,单质为黑色固体 |
| B | 单质是空气的主要成分之一 |
| C | 与B不同主族,单质为淡黄色固体,易溶于二硫化碳 |
| D | 一种非金属元素 |
| E | 与D形成的某种化合物的水溶液遇苯酚溶液显紫色 |
(2)元素A和B中非金属性更强的元素是(填名称):氮,支持此结论的一种实验事实为硝酸的酸性比碳酸的酸性强
(3)元素C和D可以形成共价化合物C2D2,该化合物中各原子都达到8电子稳定结构,则该化合物的电子式为
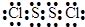
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,若生成的两种气体总体积为3360mL(已折算为标准状况)时,反应放出Q (Q>0)kJ的热量,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20QkJ•mol-1
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐:X和Y.同温下等浓度的X和Y的溶液中,pH更高的是(填名称)碳酸铵
(6)元素D和E形成的不与苯酚溶液显色的化合物为F,则检验F溶液中阳离子的方法为取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀,向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,则该反应过程中离子反应方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+(用一个总的离子方程式表示)
16.图中I是氢氧燃料电池的示意图,某同学想在II中实现Fe上镀铜,下列说法正确的是( )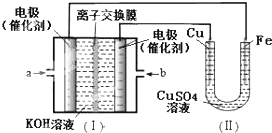

| A. | a处通入O2 | B. | b处发生氧化反应 | ||
| C. | 电流由Cu电极移向b | D. | Fe电极发生的反应为:Cu2++2e-=Cu |
17.下表中对应关系正确的是( )
| A | 甲基橙溶液呈黄色的溶液,一定能大量存在的离子 | Na+、Fe3+、Cl-、SO42- |
| B | 在久置的氯水中能大量共存的微粒 | K+、Al3+、NO3-、HCOOH |
| C | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全: | 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D | 1L0.1mol/LCuSO4溶液和足量的Ca充分反应 | 最终生成6.4gCu |
| A. | A | B. | B | C. | C | D. | D |
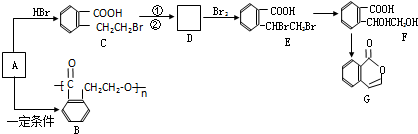
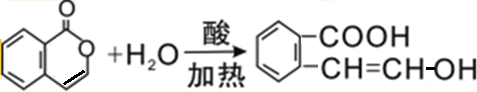
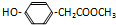 .
.