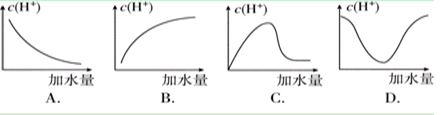
题目内容
下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中: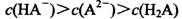 |
B.1mol/L的NaHCO3溶液中: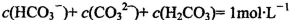 |
C.常温下,pH=7的NH4Cl与氨水的混合溶液中: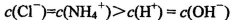 |
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中: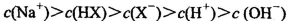 |
D
解析试题分析:A.0.lmol/L的NaHA溶液,pH=4,则C(H+)=10-3mol/L<0.lmol/L.说明H2A为弱酸,NaHA是强酸弱碱盐,由于pH=4,,说明HA-的电离大于水解,所以C(H+)>C(OH-),C(A2-) > C(H2A)。但是弱酸根离子的水解或或电离作用是很微弱的。故这几种离子的浓度大小关系是:C(HA-)> C(A2-) > C(H2A)。正确。B.1mol/L的NaHCO3溶液中:根据物料守恒可知:C(Na+)=C(HCO3-)(始)= C(HCO3-)+C(CO32-)+C(H2CO3).正确。C.常温下由于混合溶液的pH=7=10-7mol/L,所以C(H+)=C(OH-),根据电荷守恒可得:C(H+)+C(NH4+) = C(OH-)+C(Cl-),所以C(NH4+)=C(Cl-)。溶液中盐的浓度远远大于水电离产生的氢离子或氢氧根离子的浓度。所以C(NH4+)=C(Cl-)> C(H+)=C(OH-)。正确。D.等体积、等物质的量浓度的NaX和弱酸HX的混合。即n(NaX)=n(HX).可能存在弱酸HX的电离作用大于NaX的水解作用,也可能存在HX的电离作用小于NaX的水解作用。若电离>水解,则各种离子的浓度关系是:C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-);若水解>电离,则各种离子的浓度关系是:C(HX) >C(Na+)> C(X-) > C(OH->)C(H+).故错误。
考点:考查电解质溶液中微粒浓度大小比较的知识。

25℃时,水的电离可达到平衡:H2O H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
常温下,Na2CO3溶液中有平衡: 则下列说法正确的是( )
则下列说法正确的是( )
| A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+) |
| B.加入NaOH固体,溶液pH减小 |
| C.Na2CO3溶液中:c(Na+) +c(H+) =2c(CO32-) +c(OH-) |
| D.升高温度平衡向正反应方向移动 |
常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
下列说法正确的是
A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少
B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-) > c(H+)>c(OH-)
D.向NaClO溶液中滴加硫酸至中性时,2c(SO42-)= c(HClO)
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是( )
| A.分别升高温度,两种溶液的pH均减小 |
| B.相同温度下两种溶液的pH:Na2CO3> NaHCO3 |
| C.分别加入少量NaOH,两溶液中c(CO32-)均增大 |
| D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-) |
下列两种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;相同条件下,有关上述溶液的比较中,正确的是( )
| A.溶液中的c(H+):①<② |
| B.分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② |
| C.等体积的①、②溶液分别与足量铝粉反应,生成H2的量:②>① |
| D.向等体积的两种溶液中分别加入100 mL水后,溶液的pH:①>② |