题目内容
下列两种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;相同条件下,有关上述溶液的比较中,正确的是( )
| A.溶液中的c(H+):①<② |
| B.分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② |
| C.等体积的①、②溶液分别与足量铝粉反应,生成H2的量:②>① |
| D.向等体积的两种溶液中分别加入100 mL水后,溶液的pH:①>② |
B
解析试题分析:A、因为pH相同,则氢离子浓度相同,错误;B、因为CH3COOH为弱酸,所以pH=2的CH3COOH浓度更大,分别中和等体积相同物质的量浓度的NaOH溶液,则消耗ph=2的CH3COOH 溶液的体积大,正确;C、因为pH=2的CH3COOH浓度大,所以与足量锌反应生成的H2多,错误;D、加入水后,CH3COOH的电离平衡向右移动,H+浓度大,所以pH:②>①,错误。
考点:本题考查强弱电解质及其计算。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
根据下表数据,下列判断正确的是
| 电离常数(25℃) |
| HF: Ki =" 3.6×10" - 4 |
| H3PO4: Ki1=" 7.5×10" -3, Ki2=" " 6.2×10 -8, Ki3=" " 2.2×10 -13 |
A. 在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-= H2PO4-+HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合H+ 的能力:H2PO4-> HPO42->F-
下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中: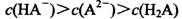 |
B.1mol/L的NaHCO3溶液中: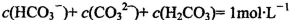 |
C.常温下,pH=7的NH4Cl与氨水的混合溶液中: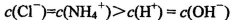 |
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中: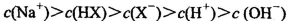 |
常温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),下列关系中一定正确的是( )
| A.c(Na+)+ c(H+)= c(HB-)+ 2c(B2-) | B.c(H+)·c(OH-)= 10-14 |
| C.c(Na+)= c(B2-)+ c(HB-) | D.溶液的pH=1 |
下列有关说法正确的是 ( )
| A.25℃时,0.1mol·L-1的三种溶液的pH关系为:pH(NaHCO3) > pH(Na2CO3) >pH(CH3COONa) |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 |
| C.25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大。 |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较( )
| A.大于 | B.等于 | C.小于 | D.不能肯定 |
下列粒子能促进水的电离,且使溶液呈酸性是
| A.CO32- | B.Fe3+ | C.HSO4- | D.Cl- |